La sinapsis es una unión intercelular especializada entre neuronas1 o entre una neurona y una célula efectora (casi siempre glandular o muscular). En estos contactos se lleva a cabo la transmisión del impulso nervioso. Éste se inicia con una descarga química que origina una corriente eléctrica en la membrana de la célula presináptica (célula emisora); una vez que este impulso nervioso alcanza el extremo del axón (la conexión con la otra célula), la propia neurona segrega un tipo de compuestos químicos (neurotransmisores) que se depositan en el espacio sináptico (espacio intermedio entre esta neurona transmisora y la neurona postsináptica o receptora). Estas sustancias segregadas o neurotransmisores (noradrenalina y acetilcolina entre otros) son los encargados de excitar o inhibir la acción de la otra célula llamada célula post sináptica.
Índice
Origen de la palabra
La palabra sinapsis viene de sinapteína, que Sir Charles Scott Sherrington y colaboradores formaron con las palabras griegas sin-, que significa "juntos", y hapteina, es decir "con firmeza".
Marco de actividad
Estos enlaces químico-eléctricos están especializados en el envío de cierto tipo de señales de pervivencia, las cuales afectan a otras neuronas, a células no neuronales como las musculares o glandulares.
Existen dos tipos de actividad base distinta, la actividad de pervivencia y la actividad de supervivencia.
La actividad sináptica de pervivencia se desarrolla en estos contextos:
Entre dos neuronas: al estímulo lo portan los neurotransmisores de tipo aminoácido.
Entre una neurona y una célula muscular: al estímulo lo portan los neurotransmisores de tipo éster.
Entre una neurona y una célula secretora: al estímulo lo portan los neurotransmisores de tipo neuropéptido.
La actividad sináptica de supervivencia se desarrolla en estos contextos:
En la actividad procreadora.
En la actividad de consumo alimenticio.
En la actividad de conservación homeostática extrema.
La sinapsis se produce en el momento en que se registra actividad químico-eléctrica presináptica y otra postsináptica. Si esta condición no se da, no se puede hablar de sinapsis." En dicha acción se liberan neurotransmisores" ionizados con base química, cuya cancelación de carga provoca la activación de receptores específicos que, a su vez, generan otro tipo de respuestas químico-eléctricas.
Cada neurona se comunica, al menos, con otras mil neuronas y puede recibir, simultáneamente, hasta diez veces más conexiones de otras. Se estima que en el cerebro humano adulto hay por lo menos 1014 conexiones sinápticas (aproximadamente, entre 100 y 500 billones). En niños alcanza los 1000 billones. Este número disminuye con el paso de los años, estabilizándose en la edad adulta.[cita requerida]
Las sinapsis permiten a las neuronas del sistema nervioso central formar una red de circuitos neuronales. Son cruciales para los procesos biológicos que subyacen bajo la percepción y el pensamiento. También son el sistema mediante el cual el sistema nervioso conecta y controla todos los sistemas del cuerpo.
Sinapsis tripartita
De acuerdo con las últimas investigaciones relacionadas con los astrocitos, esta sinapsis constaría de tres elementos: los pre y postsinápticos neuronales y los astrocitos cercanos, que funcionarían como reguladores en la transferencia de información en el interior del sistema nervioso.
Histología
Axón terminal
Dendrita
Soma
Axón
Núcleo
Nodo de
Ranvier
Axón terminal
Célula de Schwann
Vaina de mielina
Estructura de una neurona clásica
| Axón terminal |
|---|
 |
Desde el punto de vista histológico y funcional, una neurona tiene tres zonas principales: el cuerpo o soma, las dendritas y el axón. Estos dos últimos elementos son los encargados de establecer las relaciones sinápticas: las dendritas son como antenas o tentáculos que reciben la mayoría de la información que proviene de otras células; el axón, por su parte, es el cable con el que una neurona se conecta a otras.
Las conexiones pueden establecerse a muy corto alcance, a unos cientos de micrómetros a la redonda, o a distancias mucho mayores. La moto neuronas de la espina dorsal, por ejemplo, se comunican directamente con órganos como los músculos para dar lugar al movimiento (sinapsis neuromuscular).
Una sinapsis prototípica, como las que aparecen en los botones dendríticos, consiste en unas proyecciones citoplasmáticas con forma de hongo desde cada célula que, al juntarse, los extremos de ambas se aplastan uno contra otro. En esta zona, las membranas celulares de ambas células se juntan en una unión estrecha que permite a las moléculas de señal llamadas neurotransmisores pasar rápidamente de una a otra célula por difusión. El canal de unión de la neurona postsináptica es de aproximadamente 20 nm de ancho, y se conoce como hendidura sináptica.
Estas sinapsis son asimétricas tanto en su estructura como en su funcionamiento. Sólo la neurona presináptica segrega los neurotransmisores, que se unen a los receptores transmembrana que la célula postsináptica tiene en la hendidura. El terminal nervioso presináptico (también llamado botón sináptico o botón) normalmente emerge del extremo de un axón, mientras que la zona postsináptica normalmente corresponde a una dendrita, al cuerpo celular o a otras zonas celulares. La zona de la sinapsis donde se libera el neurotransmisor se denomina zona activa. En las zonas activas, las membranas de las dos células adyacentes están unidas estrechamente mediante proteínas de adhesión celular. Justo tras la membrana de la célula postsináptica aparece un complejo de proteínas entrelazadas denominado densidad postsináptica. Las proteínas de la densidad postsináptica cumplen numerosas funciones, que van desde el anclaje y movimiento de receptores de neurotransmisores de la membrana plasmática, hasta el anclaje de varias proteínas reguladoras de la actividad de estos receptores.
Tipos de sinapsis
Sinapsis eléctrica
Esquema de una sinapsis eléctrica A-B: (1) mitocondria; (2) uniones gap formadas por conexinas; (3) señal eléctrica.
Artículo principal: Sinapsis eléctrica.
Una sinapsis eléctrica es aquella en la que la transmisión entre la primera neurona y la segunda no se produce por la secreción de un neurotransmisor, como en las sinapsis químicas (véase más abajo), sino por el paso de iones de una célula a otra a través de uniones gap, pequeños canales formados por el acoplamiento de complejos proteicos, basados en conexinas, en células estrechamente adheridas.
Las sinapsis eléctricas son más rápidas que las sinapsis químicas pero menos plásticas; por lo demás, son menos propensas a alteraciones o modulación porque facilitan el intercambio entre los citoplasmas de iones y otras sustancias químicas. En los vertebrados son comunes en el corazón y el hígado.
Las sinapsis eléctricas tienen tres ventajas muy importantes:
Las sinapsis eléctricas poseen una transmisión bidireccional de los potenciales de acción, en cambio la sinapsis química solo posee la comunicación unidireccional.
En la sinapsis eléctricas hay una sincronización en la actividad neuronal lo cual hace posible una coordinada acción entre ellas.
La comunicación es más rápida en la sinapsis eléctricas que en las químicas, debido a que los potenciales de acción pasan a través del canal proteico directamente sin necesidad de la liberación de los neurotransmisores.
Sinapsis química
La sinapsis química se establece entre células que están separadas entre sí por un espacio de unos 20-30 nanómetros(nm), la llamada hendidura sináptica.
La liberación de neurotransmisores es iniciada por la llegada de un impulso nervioso (o potencial de acción), y se produce mediante un proceso muy rápido de secreción celular: en el terminal nervioso presináptico, las vesículas que contienen los neurotransmisores permanecen ancladas y preparadas junto a la membrana sináptica. Cuando llega un potencial de acción se produce una entrada de iones calcio a través de los canales de calcio dependientes de voltaje. Los iones de calcio inician una cascada de reacciones que terminan haciendo que las membranas vesiculares se fusionen con la membrana presináptica y liberando su contenido a la hendidura sináptica. Los receptores del lado opuesto de la hendidura se unen a los neurotransmisores y fuerzan la apertura de los canales iónicos cercanos de la membrana postsináptica, haciendo que los iones fluyan hacia o desde el interior, cambiando el potencial de membrana local. El resultado es excitatorio en caso de flujos de despolarización, o inhibitorio en caso de flujos de hiperpolarización. El que una sinapsis sea excitatoria o inhibitoria depende del tipo o tipos de iones que se canalizan en los flujos postsinápticos, que a su vez es función del tipo de receptores y neurotransmisores que intervienen en la sinapsis.
La suma de los impulsos excitatorios e inhibitorios que llegan por todas las sinapsis que se relacionan con cada neurona (1000 a 200.000) determina si se produce o no la descarga del potencial de acción por el axón de esa neurona.
Clases de transmisión sináptica
Se distinguen tres tipos principales de transmisión sináptica; los dos primeros mecanismos constituyen las fuerzas principales que rigen en los circuitos neuronales:
transmisión excitadora: aquella que incrementa la posibilidad de producir un potencial de acción;
transmisión inhibidora: aquella que reduce la posibilidad de producir un potencial de acción;
transmisión moduladora: aquella que cambia el patrón y/o la frecuencia de la actividad producida por las células involucradas.
Fuerza sináptica
La fuerza de una sinapsis viene dada por el cambio del potencial de membrana que ocurre cuando se activan los receptores de neurotransmisores postsinápticos. Este cambio de voltaje se denomina potencial postsináptico, y es resultado directo de los flujos iónicos a través de los canales receptores postsinápticos. Los cambios en la fuerza sináptica pueden ser a corto plazo y sin cambios permanentes en las estructuras neuronales, con una duración de segundos o minutos, o de larga duración (potenciación a largo plazo o LTP), en que la activación continuada o repetida de la sinapsis implica que los segundos mensajeros inducen la síntesis proteica en el núcleo de la neurona, alterando la estructura de la propia neurona. El aprendizaje y la memoria podrían ser resultado de cambios a largo plazo en la fuerza sináptica, mediante un mecanismo de plasticidad sináptica.
Integración de señales sinápticas
Despolarización en una célula excitable, causada por una respuesta sináptica.
Generalmente, si una sinapsis excitatoria es fuerte, un potencial de acción en la neurona presináptica iniciará otro potencial en la célula postsináptica. En una sinapsis débil, el potencial excitatorio postsináptico ("PEPS") no alcanzará el umbral para la iniciación del potencial de acción. En el cerebro, cada neurona mantiene conexiones o sinapsis con muchas otras, pudiendo recibir cada una de ellas múltiples señales. Cuando se disparan potenciales de acción simultáneamente en varias neuronas que se unen en sinapsis débiles a otra neurona, pueden forzar el inicio de un impulso en esa célula a pesar de que las sinapsis son débiles.
Por otro lado, una neurona presináptica que libera neurotransmisores inhibitorios, como el GABA, puede generar un potencial inhibitorio postsináptico ("PIPS") en la neurona postsináptica, bajando su sensibilidad y la probabilidad de que se genere un potencial de acción en ella. Así la respuesta de una neurona depende de las señales que recibe de otras, con las que puede tener distintos grados de influencia, dependiendo de la fuerza de la sinapsis con esa neurona. John Carew Eccles realizó algunos experimentos importantes en los inicios de la investigación sináptica, por los que recibió el Premio Nobel de Fisiología o Medicina en 1963. Las complejas relaciones de entrada/salida conforman las bases de la computación basada en transistores, y se cree que funcionan de forma similar en los circuitos neuronales.
Propiedades y regulación
Tras la fusión de las vesículas sinápticas y la liberación de las moléculas transmisoras en la hendidura sináptica, el neurotransmisor es rápidamente eliminado del espacio por proteínas especializadas en su reciclaje, situadas en las membranas tanto presináptica como postsináptica. Esta recaptación evita la desensibilización de los receptores postsinápticos y asegura que los potenciales de acción subsiguientes generen un PEP de la misma intensidad. La necesidad de una recaptación y el fenómeno de la desensibilización en los receptores y canales iónicos significa que la fuerza de la sinapsis puede disminuir si un tren de potenciales de acción llega en una sucesión rápida, un fenómeno que hace que exista una dependencia de la frecuencia en las sinapsis. El sistema nervioso se aprovecha de esta propiedad para computaciones, y puede ajustar las sinapsis mediante la fosforilación de las proteínas implicadas. El tamaño, número y tasa de reposición de las vesículas también está sujeto a regulación, así como otros muchos aspectos de la transmisión sináptica. Por ejemplo, un tipo de fármaco conocido como inhibidores selectivos de la recaptación de serotonina o SSRI afectan a ciertas sinapsis inhibiendo la recaptación del neurotransmisor serotonina. Por el contrario, un neurotransmisor excitatorio muy importante, la acetilcolina, no es recaptada, pero es eliminada por acción de la enzima acetilcolinesterasa.



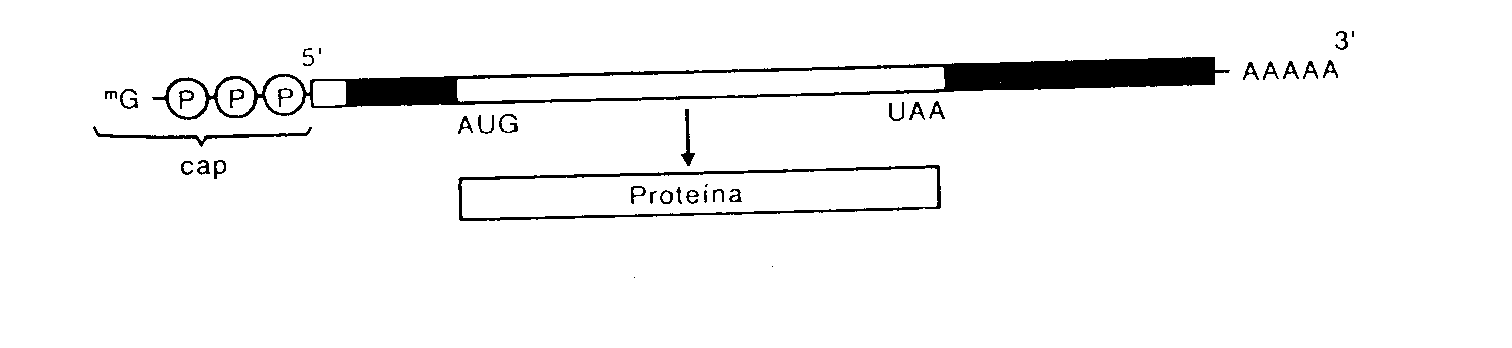
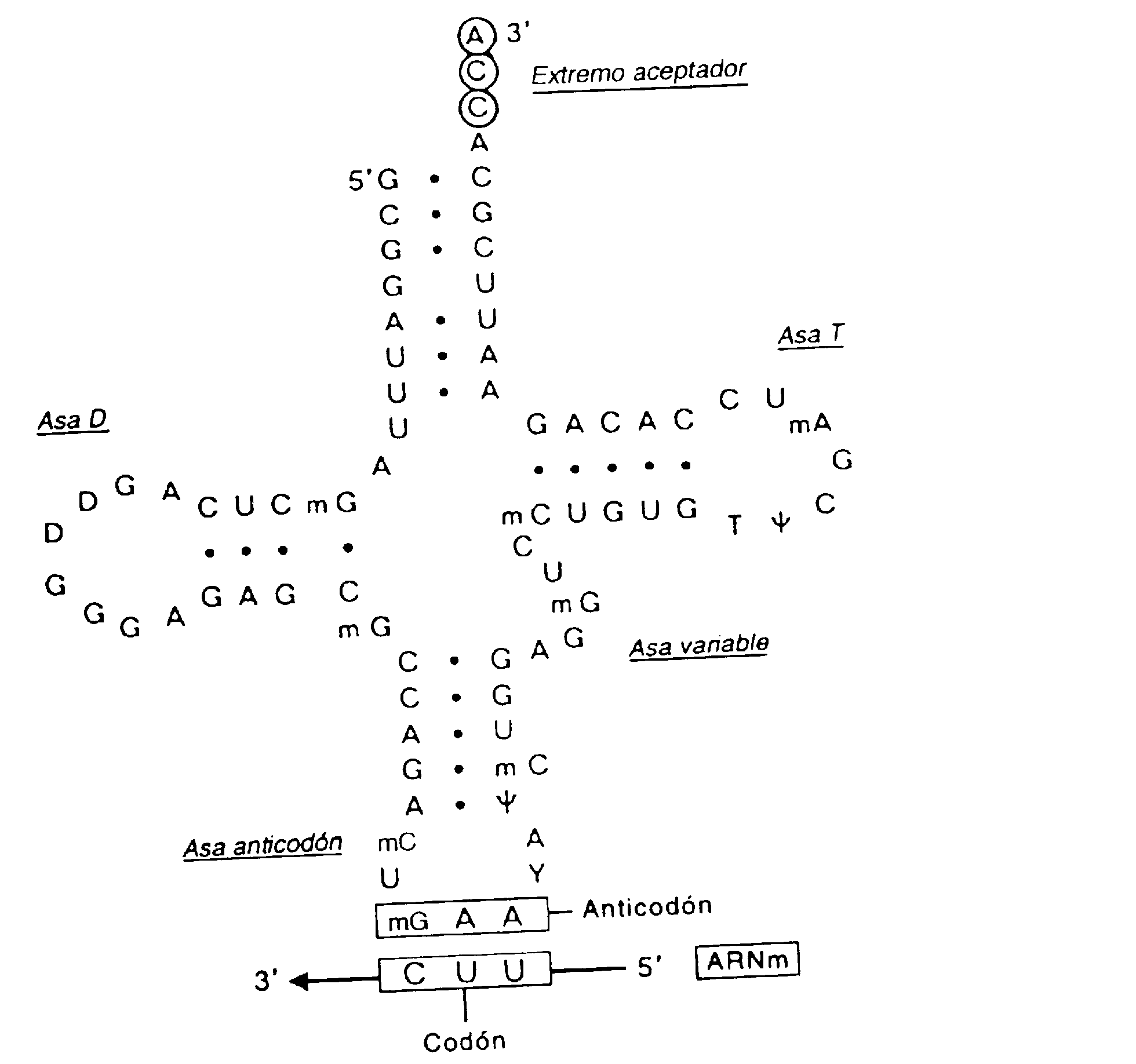 FIGURA A-3
FIGURA A-3 FIGURA A-4
FIGURA A-4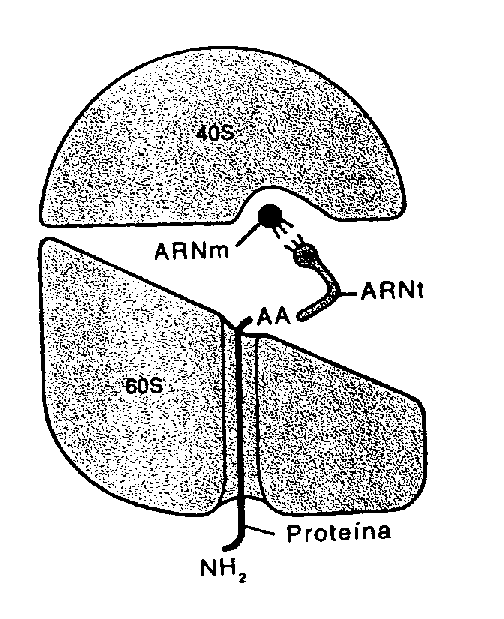 Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetiza
Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetiza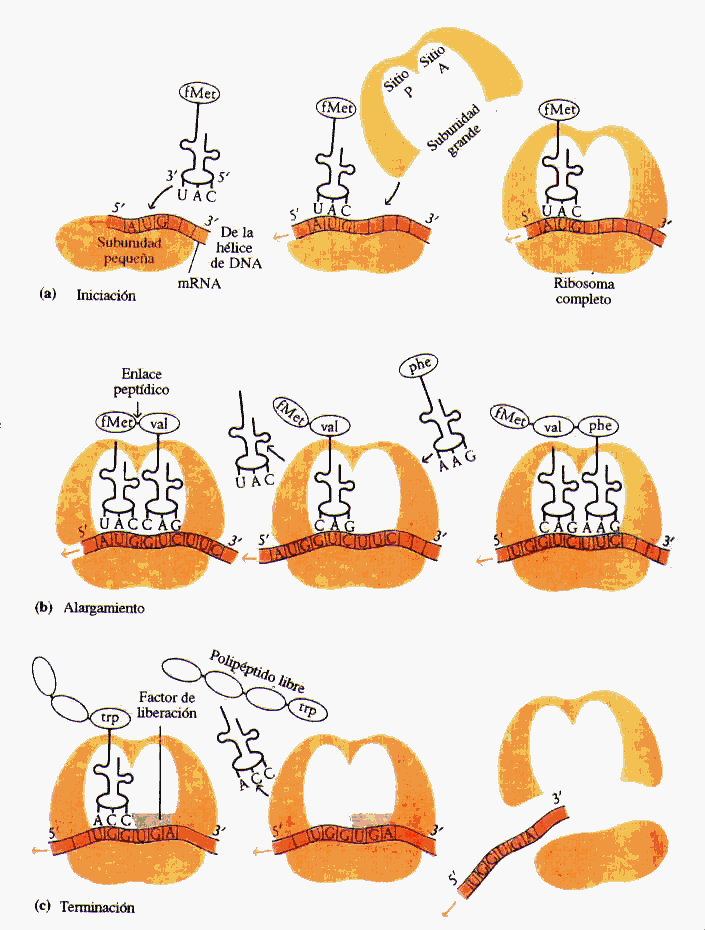 .
.