Click aquí para descargar el video.
La audición constituye los procesos psico-fisiológicos que proporcionan al ser humano la capacidad de oir.
Índice
Sonido
El sonido es la característica del medio molecular en que se encuentra el individuo. Una principales características que debe tener el sonido en que su frecuencia se mantenga entre los 20 y 20000 Hz.1 Otra de las características que posee el sonido es la amplitud que se relaciona psicológicamente con la sonoridad. Dado que el numero de amplitudes diferentes que puede oír el ser humano es muy grande se utiliza una escala logarítmica de presiones llamada de decibeles que abrevia la inmensidad de valores posibles.
Percepción
La audición es la percepción de las ondas sonoras que se propagan por el espacio, en primer lugar, por nuestras orejas, que las transmiten por los conductos auditivos externos hasta que chocan con el tímpano, haciéndolo vibrar. Estas vibraciones generan movimientos oscilantes en la cadena de huesecillos del oído medio (martillo, yunque y estribo), los que son conducidos hasta el perilinfa del caracol. Aquí las ondas mueven los cilios de las células nerviosas del Órgano de Corti que, a su vez, estimulan las terminaciones nerviosas del nervio auditivo. O sea, en el Órgano de Corti las vibraciones se transforman en impulsos nerviosos, los que son conducidos, finalmente, a la corteza cerebral, en donde se interpretan como sensaciones auditivas. Como también se puede mandar al cerebro para dar la señal de los sonidos que generan las ondas sonoras.
Proceso de la audición humana
Más allá de las ondas sonoras (física del sonido), el proceso de la audición humana implica procesos fisiológicos, derivados de la estimulación de los órganos de la audición, y procesos psicológicos, derivados del acto consciente de escuchar un sonido.
El oído capta los sonidos de la siguiente manera:
La oreja capta las ondas sonoras que se transmiten a través del conducto auditivo hasta el tímpano. El tímpano es una membrana flexible que vibra cuando le llegan las ondas sonoras. Esta vibración llega a la cadena de huesecillos que amplifican el sonido y lo transmite al oído interno a través de la ventana oval. Finalmente las vibraciones "mueven" los dos líquidos que existen en la cóclea (perilinfa y endolinfa), deformando las células ciliadas existentes en el interior. Estas células transforman las ondas sonoras en impulsos eléctricos que llegan al nervio auditivo y de este nervio a la corteza auditiva que es el órgano encargado de interpretar los sonidos.
El lóbulo temporal se ocupa de varias funciones, incluido el lenguaje. Cuando se escucha música, o hablar a alguien esta región está tratando de descifrar la información. El procesamiento de información de audio y memoria auditiva se gestionan aquí.2
Divisiones del sistema auditivo
Podemos dividir el sistema auditivo en dos partes:
Sistema auditivo periférico (el oído), responsable de los procesos fisiológicos que captan el sonido y lo envía al cerebelo.
Sistema auditivo central (nervios auditivos y cerebro), responsable de los movimientos psicológicos que conforman lo que se conoce como percepción sonora.
Universidad Autonoma de Sinaloa Facultad de Médicina Javier Fajardo Noriega III-4
domingo, 2 de diciembre de 2012
sábado, 1 de diciembre de 2012
Clambres Musculares
click aquí para ver el archivo.
Los calambres musculares son
contracciones o espasmos súbitos, involuntarios en uno o más músculos.
Generalmente ocurren después del ejercicio o por la noche y duran desde
algunos segundos hasta varios minutos. Es un problema muscular muy
común.
Los calambres musculares pueden ser causados por el mal
funcionamiento de algunos nervios. Algunas veces, este mal
funcionamiento se debe a un problema de salud, tales como una lesión de
la médula espinal o a un nervio pinzado en el cuello o la espalda. Otras
causas son:
- Distensiones o exceso de uso de un músculo
- Deshidratación
- Falta de minerales en la dieta o desgaste de minerales en el cuerpo
- Llegada insuficiente de sangre a los músculos
Contraciión Muscular.
Click aquí para ver una bella animación :3.
Contracción muscular
La contracción de los músculos estriados ocurre como resultado de un esfuerzo consciente originado en el cerebro. Las señales del cerebro viajan muy rápido en la forma de potenciales de acción por los nervios hasta la neurona motora que injerta fibra muscular. En el caso de los reflejos involuntarios, la señal eréctil puede originarse en la médula espinal a través de un circuito con la materia gris. En la musculatura involuntaria, como son el caso del corazón y la musculatura lisa (por ejemplo, en el intestino o el sistema vascular), la contracción ocurre como resultado de actividad inconsciente del sistema nervioso autónomo o bien por estimulación endógena del mismo músculo. Algunas contracciones como la locomoción, la respiración, y la masticación pueden iniciarse tanto consciente como inconscientemente, pero se continúan por medio de un reflejo inconsciente.
La contracción muscular se puede explicar como un desplazamiento de los miofilamentos, es decir la cabeza de la miosina se ancla a la actina produciéndose así el dicho desplazamiento. Cabe decir que la contracción muscular está regulada por el calcio, el ATP y el Magnesio, aunque se desconoce porque el Magnesio causa contracción en músculos post mortem y esto está bajo investigación.
Músculo estriado
S = sarcómero, A = banda-A, I = banda-I, H = zona-H, Z = línea-Z, M = línea-M.
microscopio, debido al altamente organizado patrón de bandas A y bandas I. En estado de relajación las fibras de miosina y actina, las proteínas en los filamentos de la zona A, apenas se superponen entre sí, mientras que la actina se superpone casi al completo sobre los filamentos de miosina en el estado de contracción. Los filamentos de actina, se han desplazado sobre los filamentos de miosina y sobre ellos mismos, de tal manera que se entrelazan entre sí en mayor mecanismo de deslizamiento de filamentos.
La contracción dependera de los niveles de Ca^(2+) citoplasmatico. El calcio al unirse a la troponina que recubre la actina, deja libre los puntos de union de esta con la miosina. El hecho de que aumenten las concentraciones citoplasmaticas radica en la invervacion que tiene el musculo estriado. Cuando una neurona motora desarrolla un PA sobre el m. estriado esqueletico (el cardiaco tiene contraccion propia, sin neurona motora) se liberara Acetilcolina sobre las celulas musculares (uniendose a su receptor nicotinico ionotropico), esto provocará una despolarización en la membrana que se transmitira a lo largo del musculo. La despolarizacion llegará al Reticulo Sarcoplasmico y gracias a los Tubos T se aproximara el potencial para la liberacion intracelular del Ca acumulado. Esta [Ca] aun no será suficiente para producir la contraccion por lo que también habra una entrada de calcio extracelular por los canales de Ca. De esta manera los puntos de union miosina-actina estan libres y al unirse se produce la contraccion. Cuando llega el momento de la relajación habra que romper los enlaces para que el musculo no este contraido. Estos enlaces se rompen gracias a la acción de la miosina como ATPasa, que por hidrolisis de ATP rompe el enlace. Este proceso se vera favorecido solo cuando las [Ca] disminuyan. Esto es posible gracias a la existencia de bombas de Ca en el reticulo sarcoplasmico que vuelven a guardar el Ca (1ATP hidrolizado por cada 2Ca que entran), la presencia del intercambiador Na-Ca en la membrana celular permitirá la salida de mas Ca al medio extracelular. Si alguna de estas bombas fallaran se produciria la Tetanización (los músculos quedan contraidos)
Los filamentos de actina se deslizan hacia adentro entre los filamentos de miosina debido a fuerzas de atracción resultantes de fuerzas mecánicas, químicas y electrostáticas generadas por la interacción de los puentes cruzados de los filamentos de actina.
En reposo, las fuerzas de atracción entre los filamentos de actina y miosina están inhibidas.
Los potenciales de acción se originan en el sistema nervioso central y viaja hasta llegar a la membrana de la motoneurona: la fibra muscular.
El potencial de acción activa los canales de calcio dependientes de voltaje en el axón haciendo que el calcio fluya dentro de la neurona.
El calcio hace que las vesículas, conteniendo el neurotransmisor llamado acetilcolina, se unan a la membrana celular de la neurona, liberando la acetilcolina al espacio sináptico donde se encuentran la neurona con la fibra muscular estriada.
La acetilcolina activa receptores nicotínicos de la acetilcolina en la fibra muscular abriendo los canales para sodio y potasio haciendo que ambos se muevan hacia donde sus concentraciones sean menores: sodio hacia dentro de la célula y potasio hacia fuera.
La nueva diferencia de cargas causada por la migración de sodio y potasio despolariza (la hace más positiva) el interior de la membrana, activando canales de calcio dependientes de voltaje localizados en la membrana celular (canales de dihidropiridina) los cuales por medio de un cambio conformacional terminan activando de manera mecánica a los receptores de Ryanodina ubicados en el retículo endoplásmico de la fibra muscular, llamado retículo sarcoplasmático (RS).
El calcio sale del retículo sarcoplasmático y se une a la proteína troponina C, presente como parte del filamento de actina, haciendo que module con la tropomiosina, cuya función es obstruir el sitio de unión entre la actina y la miosina.
Libre del obstáculo de la tropomiosina, ocurre la liberación de grandes cantidades de iones calcio hacia el sarcoplasma. Estos iones calcio activan las fuerzas de atracción en los filamentos, y comienza la contracción.
La miosina, lista con anticipación por la compañía energética de ATP se une a la actina de manera fuerte, liberando el ADP y el fosfato inorgánico causando un fuerte halón de la actina, acortando las bandas I una a la otra y produciendo contracción de la fibra muscular.
En todo este proceso también se necesita energía para mantener la contracción muscular, que proviene de los enlaces ricos en energía del adenosintrifosfato (ATP), que se desintegra en adenosindifosfato (ADP) para proporcionar la energía requerida.
Tipos de contracciones musculares
Contracciones isotónicas
La palabra isotonicas significa (iso: igual - tónica: tensión) igual tensión.
Se define como contracciones isotónicas a aquellas (desde el punto de vista fisiológico) contracciones en las que las fibras musculares además de contraerse, modifican su longitud.
Las contracciones isotónicas son las más comunes en la mayoría de los deportes, actividades físicas y actividades correspondientes a la vida diaria, ya que en la mayoría de las tensiones musculares que se ejercen suelen ir acompañadas por acortamiento y alargamiento de las fibras musculares de un músculo determinado.
Las contracciones isotónicas se dividen en: concéntricas y excéntricas.
Contracciones concéntricas
Una contracción concéntrica ocurre cuando un músculo desarrolla una tensión suficiente para superar una resistencia, de forma tal que éste se acorta, y moviliza una parte del cuerpo venciendo dicha resistencia. Un claro ejemplo es cuando llevamos un vaso de agua a la boca para beber, existe acortamiento muscular concéntrico, ya que los puntos de inserción de los músculos se juntan, se acortan o se contraen.
En el gimnasio podríamos poner los siguientes ejemplos:
a. Máquina de extensiones.
Cuando levantamos las pesas, el músculo cuádriceps se acorta con lo cual se produce la contracción concéntrica. Aquí los puntos de inserción del músculo cuádripces se acercan, por ello decimos que se produce una contracción concéntrica.
b. Tríceps con polea.
Al bajar el brazo y extenderlo para entrenar el tríceps, estamos contrayendo el tríceps en forma concéntrica. Aquí los puntos de inserción del músculo tríceps braquial se acercan, por ello decimos que se produce una contracción concéntrica.
En síntesis, decimos que cuando los puntos de inserción de un músculo se acercan, la contracción que se produce es «concéntrica».
Contracciones excéntricas
Cuando una resistencia dada es mayor que la tensión ejercida por un músculo determinado, de forma que éste se alarga, se dice que dicho músculo ejerce una contracción excéntrica. En este caso el músculo desarrolla tensión alargándose, es decir, extendiendo su longitud. Un ejemplo claro es cuando llevamos el vaso desde la boca hasta apoyarlo en la mesa, en este caso el bíceps braquial se contrae excéntricamente. En este caso actúa la fuerza de gravedad, ya que si no, se produciría una contracción excéntrica y se relajarían los músculos del brazo, y el vaso caería hacia el suelo a la velocidad de la fuerza de gravedad. Para que esto no ocurra, el músculo se extiende contrayéndose en forma excéntrica.
En este caso podemos decir que cuando los puntos de inserción de un músculo se alargan, se produce una contracción excéntrica. Aquí se suele utilizar el término alargamiento bajo tensión. Este vocablo «alargamiento», suele prestarse a confusión ya que si bien el músculo se alarga y extiende, lo hace bajo tensión y yendo más lejos no hace más que volver a su posición natural de reposo.
a. Máquina de extensiones.
Cuando bajamos las pesas, el músculo cuádripces se extiende, pero se está produciendo una contracción excéntrica. Aquí los puntos de inserción del músculo cuádripces se alejan, por ello decimos que se produce una contracción excéntrica.
b. Tríceps con polea.
Al subir el brazo el tríceps braquial se extiende bajo resistencia. Aquí los puntos de inserción del músculo tríceps braquial se alejan, por ello decimos que se produce una contracción «excéntrica».
Contracciones isométricas
La palabra isométrica significa (iso: igual, métrica: medida/longitud) igual medida o igual longitud.
En este caso el músculo permanece estático, sin acortarse ni alargarse, pero aunque permanece estático genera tensión. Un ejemplo de la vida cotidiana sería cuando llevamos a un chico en brazos, los brazos no se mueven, mantienen al niño en la misma posición y generan tensión para que el niño no se caiga al suelo. No se produce ni acortamiento ni alargamiento de las fibras musculares.
En el deporte se produce en muchos casos, un ejemplo podría ser en ciertos momentos del wind surf, cuando debemos mantener la vela en una posición fija. Con lo cual podríamos decir que se genera una contracción estática, cuando generando tensión no se produce modificación en la longitud de un músculo determinado.
Contracciones auxotónicas
Este caso es cuando se combinan contracciones isotónicas con contracciones isométricas. Al iniciarse la contracción, se acentúa más la parte isotónica, mientras que al final de la contracción se acentúa más la isométrica.
Un ejemplo práctico de este tipo de contracción lo encontramos cuando se trabaja con «"extensores"». El extensor se estira hasta un cierto punto, el músculo se contrae concéntricamente, mantenemos unos segundos estáticamente (isométricamente) y luego volvemos a la posición inicial con una contracción en forma excéntrica.
Contracciones isocinéticas
Se trata más bien de un nuevo tipo de contracción, por lo menos en lo que refiere a su aplicación en la práctica deportiva. Se define como una contracción máxima a velocidad constante en toda la gama de movimiento. Son comunes en aquellos deportes en lo que no se necesita generar una aceleración en el movimiento, es decir, en aquellos deportes en los que lo que necesitamos es una velocidad constante y uniforme, como puede ser la natación o el remo. El agua ejerce una fuerza constante y uniforme, cuando aumentamos la fuerza, el agua aumenta en la resistencia. Para ello se diseñaron los aparatos isocinéticos, para desarrollar a velocidad constante y uniforme durante todo el movimiento.
Aunque las contracciones isocinéticas e isotónicas son ambas concéntricas y excéntricas, no son idénticas, sino por el contrario son bastante distintas, ya que como dijimos anteriormente las contracciones isocinéticas son a velocidad constante regulada y se desarrolla una tensión máxima durante todo el movimiento. En las contracciones isotónicas no se controla la velocidad del movimiento con ningún dispositivo, y además no se ejerce la misma tensión durante el movimiento, ya que por una cuestión de palancas óseas varía la tensión a medida que se realiza el ejercicio. Por ejemplo, en extensiones de cuádripces cuando comenzamos el ejercicio, ejercemos mayor tensión que al finalizar por varias razones:
una es por que vencemos la inercia.
la otra es porque al acercarse los puntos de inserción muscular, el músculo ejerce menor tensión.
En el caso de los ejercicios isocinéticos, éstas máquinas están preparadas para que ejerzan la misma tensión y velocidad en toda la gama de movimiento.
Para realizar un entrenamiento con máquinas isocinéticas se necesitan equipos especiales. Dichos equipos contienen básicamente, un regulador de velocidad, de manera que la velocidad del movimiento se mantiene constante, cualquiera que sea la tensión producida en los músculos que se contraen. De modo que si alguien intenta que el movimiento sea tan rápido como resulte posible, la tensión engendrada por los músculos será máxima durante toda la gama de movimiento, pero su velocidad se mantendrá constante.
Es posible regular la velocidad del movimiento en muchos de estos dispositivos isocinéticos y la misma puede variar entre 0º y 200º de movimiento por segundo. Muchas velocidades de movimiento durante diversas pruebas atléticas reales superan los 100º/s .
Otras de estas máquinas tienen la posibilidad de leer e imprimir la tensión muscular generada.
Lamentablemente, dichos dispositivos solo están disponibles en centros de alto rendimiento deportivo por sus altos costos. No cabe duda que la ganancia de fuerza muscular es mucho mayor con dichos tipos de entrenamiento, pero hay que tener en cuenta que en muchos deportes se necesita vencer la inercia y generar una aceleración, y por ello este tipo de dispositivos no serían muy adecuados para ello, ya que .
Relajación
La relajación es el momento en que la contracción da fin. Las diferentes fibras (miosina, actina) entran en su lugar y se encuentran con la aparición de la estría H. La relajación es el resultado del fin del impulso nervioso en la placa neuromuscular.
Contracción muscular
La contracción de los músculos estriados ocurre como resultado de un esfuerzo consciente originado en el cerebro. Las señales del cerebro viajan muy rápido en la forma de potenciales de acción por los nervios hasta la neurona motora que injerta fibra muscular. En el caso de los reflejos involuntarios, la señal eréctil puede originarse en la médula espinal a través de un circuito con la materia gris. En la musculatura involuntaria, como son el caso del corazón y la musculatura lisa (por ejemplo, en el intestino o el sistema vascular), la contracción ocurre como resultado de actividad inconsciente del sistema nervioso autónomo o bien por estimulación endógena del mismo músculo. Algunas contracciones como la locomoción, la respiración, y la masticación pueden iniciarse tanto consciente como inconscientemente, pero se continúan por medio de un reflejo inconsciente.
La contracción muscular se puede explicar como un desplazamiento de los miofilamentos, es decir la cabeza de la miosina se ancla a la actina produciéndose así el dicho desplazamiento. Cabe decir que la contracción muscular está regulada por el calcio, el ATP y el Magnesio, aunque se desconoce porque el Magnesio causa contracción en músculos post mortem y esto está bajo investigación.
Músculo estriado
S = sarcómero, A = banda-A, I = banda-I, H = zona-H, Z = línea-Z, M = línea-M.
microscopio, debido al altamente organizado patrón de bandas A y bandas I. En estado de relajación las fibras de miosina y actina, las proteínas en los filamentos de la zona A, apenas se superponen entre sí, mientras que la actina se superpone casi al completo sobre los filamentos de miosina en el estado de contracción. Los filamentos de actina, se han desplazado sobre los filamentos de miosina y sobre ellos mismos, de tal manera que se entrelazan entre sí en mayor mecanismo de deslizamiento de filamentos.
La contracción dependera de los niveles de Ca^(2+) citoplasmatico. El calcio al unirse a la troponina que recubre la actina, deja libre los puntos de union de esta con la miosina. El hecho de que aumenten las concentraciones citoplasmaticas radica en la invervacion que tiene el musculo estriado. Cuando una neurona motora desarrolla un PA sobre el m. estriado esqueletico (el cardiaco tiene contraccion propia, sin neurona motora) se liberara Acetilcolina sobre las celulas musculares (uniendose a su receptor nicotinico ionotropico), esto provocará una despolarización en la membrana que se transmitira a lo largo del musculo. La despolarizacion llegará al Reticulo Sarcoplasmico y gracias a los Tubos T se aproximara el potencial para la liberacion intracelular del Ca acumulado. Esta [Ca] aun no será suficiente para producir la contraccion por lo que también habra una entrada de calcio extracelular por los canales de Ca. De esta manera los puntos de union miosina-actina estan libres y al unirse se produce la contraccion. Cuando llega el momento de la relajación habra que romper los enlaces para que el musculo no este contraido. Estos enlaces se rompen gracias a la acción de la miosina como ATPasa, que por hidrolisis de ATP rompe el enlace. Este proceso se vera favorecido solo cuando las [Ca] disminuyan. Esto es posible gracias a la existencia de bombas de Ca en el reticulo sarcoplasmico que vuelven a guardar el Ca (1ATP hidrolizado por cada 2Ca que entran), la presencia del intercambiador Na-Ca en la membrana celular permitirá la salida de mas Ca al medio extracelular. Si alguna de estas bombas fallaran se produciria la Tetanización (los músculos quedan contraidos)
Los filamentos de actina se deslizan hacia adentro entre los filamentos de miosina debido a fuerzas de atracción resultantes de fuerzas mecánicas, químicas y electrostáticas generadas por la interacción de los puentes cruzados de los filamentos de actina.
En reposo, las fuerzas de atracción entre los filamentos de actina y miosina están inhibidas.
Los potenciales de acción se originan en el sistema nervioso central y viaja hasta llegar a la membrana de la motoneurona: la fibra muscular.
El potencial de acción activa los canales de calcio dependientes de voltaje en el axón haciendo que el calcio fluya dentro de la neurona.
El calcio hace que las vesículas, conteniendo el neurotransmisor llamado acetilcolina, se unan a la membrana celular de la neurona, liberando la acetilcolina al espacio sináptico donde se encuentran la neurona con la fibra muscular estriada.
La acetilcolina activa receptores nicotínicos de la acetilcolina en la fibra muscular abriendo los canales para sodio y potasio haciendo que ambos se muevan hacia donde sus concentraciones sean menores: sodio hacia dentro de la célula y potasio hacia fuera.
La nueva diferencia de cargas causada por la migración de sodio y potasio despolariza (la hace más positiva) el interior de la membrana, activando canales de calcio dependientes de voltaje localizados en la membrana celular (canales de dihidropiridina) los cuales por medio de un cambio conformacional terminan activando de manera mecánica a los receptores de Ryanodina ubicados en el retículo endoplásmico de la fibra muscular, llamado retículo sarcoplasmático (RS).
El calcio sale del retículo sarcoplasmático y se une a la proteína troponina C, presente como parte del filamento de actina, haciendo que module con la tropomiosina, cuya función es obstruir el sitio de unión entre la actina y la miosina.
Libre del obstáculo de la tropomiosina, ocurre la liberación de grandes cantidades de iones calcio hacia el sarcoplasma. Estos iones calcio activan las fuerzas de atracción en los filamentos, y comienza la contracción.
La miosina, lista con anticipación por la compañía energética de ATP se une a la actina de manera fuerte, liberando el ADP y el fosfato inorgánico causando un fuerte halón de la actina, acortando las bandas I una a la otra y produciendo contracción de la fibra muscular.
En todo este proceso también se necesita energía para mantener la contracción muscular, que proviene de los enlaces ricos en energía del adenosintrifosfato (ATP), que se desintegra en adenosindifosfato (ADP) para proporcionar la energía requerida.
Tipos de contracciones musculares
Contracciones isotónicas
La palabra isotonicas significa (iso: igual - tónica: tensión) igual tensión.
Se define como contracciones isotónicas a aquellas (desde el punto de vista fisiológico) contracciones en las que las fibras musculares además de contraerse, modifican su longitud.
Las contracciones isotónicas son las más comunes en la mayoría de los deportes, actividades físicas y actividades correspondientes a la vida diaria, ya que en la mayoría de las tensiones musculares que se ejercen suelen ir acompañadas por acortamiento y alargamiento de las fibras musculares de un músculo determinado.
Las contracciones isotónicas se dividen en: concéntricas y excéntricas.
Contracciones concéntricas
Una contracción concéntrica ocurre cuando un músculo desarrolla una tensión suficiente para superar una resistencia, de forma tal que éste se acorta, y moviliza una parte del cuerpo venciendo dicha resistencia. Un claro ejemplo es cuando llevamos un vaso de agua a la boca para beber, existe acortamiento muscular concéntrico, ya que los puntos de inserción de los músculos se juntan, se acortan o se contraen.
En el gimnasio podríamos poner los siguientes ejemplos:
a. Máquina de extensiones.
Cuando levantamos las pesas, el músculo cuádriceps se acorta con lo cual se produce la contracción concéntrica. Aquí los puntos de inserción del músculo cuádripces se acercan, por ello decimos que se produce una contracción concéntrica.
b. Tríceps con polea.
Al bajar el brazo y extenderlo para entrenar el tríceps, estamos contrayendo el tríceps en forma concéntrica. Aquí los puntos de inserción del músculo tríceps braquial se acercan, por ello decimos que se produce una contracción concéntrica.
En síntesis, decimos que cuando los puntos de inserción de un músculo se acercan, la contracción que se produce es «concéntrica».
Contracciones excéntricas
Cuando una resistencia dada es mayor que la tensión ejercida por un músculo determinado, de forma que éste se alarga, se dice que dicho músculo ejerce una contracción excéntrica. En este caso el músculo desarrolla tensión alargándose, es decir, extendiendo su longitud. Un ejemplo claro es cuando llevamos el vaso desde la boca hasta apoyarlo en la mesa, en este caso el bíceps braquial se contrae excéntricamente. En este caso actúa la fuerza de gravedad, ya que si no, se produciría una contracción excéntrica y se relajarían los músculos del brazo, y el vaso caería hacia el suelo a la velocidad de la fuerza de gravedad. Para que esto no ocurra, el músculo se extiende contrayéndose en forma excéntrica.
En este caso podemos decir que cuando los puntos de inserción de un músculo se alargan, se produce una contracción excéntrica. Aquí se suele utilizar el término alargamiento bajo tensión. Este vocablo «alargamiento», suele prestarse a confusión ya que si bien el músculo se alarga y extiende, lo hace bajo tensión y yendo más lejos no hace más que volver a su posición natural de reposo.
a. Máquina de extensiones.
Cuando bajamos las pesas, el músculo cuádripces se extiende, pero se está produciendo una contracción excéntrica. Aquí los puntos de inserción del músculo cuádripces se alejan, por ello decimos que se produce una contracción excéntrica.
b. Tríceps con polea.
Al subir el brazo el tríceps braquial se extiende bajo resistencia. Aquí los puntos de inserción del músculo tríceps braquial se alejan, por ello decimos que se produce una contracción «excéntrica».
Contracciones isométricas
La palabra isométrica significa (iso: igual, métrica: medida/longitud) igual medida o igual longitud.
En este caso el músculo permanece estático, sin acortarse ni alargarse, pero aunque permanece estático genera tensión. Un ejemplo de la vida cotidiana sería cuando llevamos a un chico en brazos, los brazos no se mueven, mantienen al niño en la misma posición y generan tensión para que el niño no se caiga al suelo. No se produce ni acortamiento ni alargamiento de las fibras musculares.
En el deporte se produce en muchos casos, un ejemplo podría ser en ciertos momentos del wind surf, cuando debemos mantener la vela en una posición fija. Con lo cual podríamos decir que se genera una contracción estática, cuando generando tensión no se produce modificación en la longitud de un músculo determinado.
Contracciones auxotónicas
Este caso es cuando se combinan contracciones isotónicas con contracciones isométricas. Al iniciarse la contracción, se acentúa más la parte isotónica, mientras que al final de la contracción se acentúa más la isométrica.
Un ejemplo práctico de este tipo de contracción lo encontramos cuando se trabaja con «"extensores"». El extensor se estira hasta un cierto punto, el músculo se contrae concéntricamente, mantenemos unos segundos estáticamente (isométricamente) y luego volvemos a la posición inicial con una contracción en forma excéntrica.
Contracciones isocinéticas
Se trata más bien de un nuevo tipo de contracción, por lo menos en lo que refiere a su aplicación en la práctica deportiva. Se define como una contracción máxima a velocidad constante en toda la gama de movimiento. Son comunes en aquellos deportes en lo que no se necesita generar una aceleración en el movimiento, es decir, en aquellos deportes en los que lo que necesitamos es una velocidad constante y uniforme, como puede ser la natación o el remo. El agua ejerce una fuerza constante y uniforme, cuando aumentamos la fuerza, el agua aumenta en la resistencia. Para ello se diseñaron los aparatos isocinéticos, para desarrollar a velocidad constante y uniforme durante todo el movimiento.
Aunque las contracciones isocinéticas e isotónicas son ambas concéntricas y excéntricas, no son idénticas, sino por el contrario son bastante distintas, ya que como dijimos anteriormente las contracciones isocinéticas son a velocidad constante regulada y se desarrolla una tensión máxima durante todo el movimiento. En las contracciones isotónicas no se controla la velocidad del movimiento con ningún dispositivo, y además no se ejerce la misma tensión durante el movimiento, ya que por una cuestión de palancas óseas varía la tensión a medida que se realiza el ejercicio. Por ejemplo, en extensiones de cuádripces cuando comenzamos el ejercicio, ejercemos mayor tensión que al finalizar por varias razones:
una es por que vencemos la inercia.
la otra es porque al acercarse los puntos de inserción muscular, el músculo ejerce menor tensión.
En el caso de los ejercicios isocinéticos, éstas máquinas están preparadas para que ejerzan la misma tensión y velocidad en toda la gama de movimiento.
Para realizar un entrenamiento con máquinas isocinéticas se necesitan equipos especiales. Dichos equipos contienen básicamente, un regulador de velocidad, de manera que la velocidad del movimiento se mantiene constante, cualquiera que sea la tensión producida en los músculos que se contraen. De modo que si alguien intenta que el movimiento sea tan rápido como resulte posible, la tensión engendrada por los músculos será máxima durante toda la gama de movimiento, pero su velocidad se mantendrá constante.
Es posible regular la velocidad del movimiento en muchos de estos dispositivos isocinéticos y la misma puede variar entre 0º y 200º de movimiento por segundo. Muchas velocidades de movimiento durante diversas pruebas atléticas reales superan los 100º/s .
Otras de estas máquinas tienen la posibilidad de leer e imprimir la tensión muscular generada.
Lamentablemente, dichos dispositivos solo están disponibles en centros de alto rendimiento deportivo por sus altos costos. No cabe duda que la ganancia de fuerza muscular es mucho mayor con dichos tipos de entrenamiento, pero hay que tener en cuenta que en muchos deportes se necesita vencer la inercia y generar una aceleración, y por ello este tipo de dispositivos no serían muy adecuados para ello, ya que .
Relajación
La relajación es el momento en que la contracción da fin. Las diferentes fibras (miosina, actina) entran en su lugar y se encuentran con la aparición de la estría H. La relajación es el resultado del fin del impulso nervioso en la placa neuromuscular.
viernes, 19 de octubre de 2012
Sistema Nervioso Autonomo,
Click aquí para ver archivo.
El sistema nervioso autónomo (SNA), también conocido como sistema nervioso vegetativo, es la parte del sistema nervioso que controla las acciones involuntarias,1 a diferencia del sistema nervioso somático. El sistema nervioso autónomo recibe la información de las vísceras y del medio interno, para actuar sobre sus músculos, glándulas y vasos sanguíneos.
El sistema nervioso autónomo es sobre todo un sistema eferente, es decir, transmite impulsos nerviosos desde el sistema nervioso central hasta la periferia estimulando los aparatos y sistemas órganos periféricos. Sus vías neuronales actúan sobre la frecuencia cardíaca y respiratoria, la contracción y dilatación de vasos sanguíneos, digestión, salivación, el sudor, la contracción y relajación del músculo liso en varios órganos, acomodación visual, tamaño de la pupila, secreción de glándulas exocrinas y endocrinas, la micción y la excitación sexual. La mayoría de las acciones del que controla son involuntarias, aunque algunas, como la respiración, actúan junto con acciones conscientes.2 El mal funcionamiento de este sistema puede provocar diversos síntomas, que se agrupan bajo el nombre genérico de disautonomía.
El sistema nervioso autónomo o neurovegetativo, al contrario del sistema nervioso somático y central, es involuntario activándose principalmente por centros nerviosos situados en la médula espinal, tallo cerebral e hipotálamo. También, algunas porciones de la corteza cerebral como la corteza límbica, pueden transmitir impulsos a los centros inferiores y así, influir en el control autónomo.3
Los nervios autónomos están formados por todas las fibras eferentes que abandonan el sistema nervioso central, excepto aquellas que inervan el músculo esquelético. Existen fibras autonómicas aferentes, que transmiten información desde la periferia al sistema nervioso central, encargándose de transmitir la sensación visceral y la regulación de reflejos vasomotores y respiratorios, por ejemplo los barorreceptores y quimiorreceptores del seno carotídeo y arco aórtico que son muy importantes en el control del ritmo cardíaco, presión sanguínea y movimientos respiratorios. Estas fibras aferentes son transportadas al sistema nervioso central por nervios autonómicos principales como el neumogástrico, nervios esplácnicos o nervios pélvicos.
También el sistema nervioso autónomo funciona a través de reflejos viscerales, es decir, las señales sensoriales que entran en los ganglios autónomos, la médula espinal, el tallo cerebral o el hipotálamo pueden originar respuestas reflejas adecuadas que son devueltas a los órganos para controlar su actividad.4 Reflejos simples terminan en los órganos correspondientes, mientras que reflejos más complejos son controlados por centros autonómicos superiores en el sistema nervioso central, principalmente el hipotálamo.
Estructura
El sistema nervioso vegetativo se divide funcionalmente en:
Sistema simpático: usa noradrenalina y adrenalina como neurotransmisor, y lo constituyen una cadena de ganglios paravertebrales situados a ambos lados de la columna vertebral que forman el llamado tronco simpático, así como unos ganglios prevertebrales o preaórticos, adosados a la cara anterior de la aorta (ganglios celíacos, aórtico-renales, mesentérico superior y mesentérico inferior). Está implicado en actividades que requieren gasto de energía. También es llamado sistema adrenérgico o noradrenérgico; ya que es el que prepara al cuerpo para reaccionar ante una situación de estrés.5
Sistema parasimpático: Lo forman los ganglios aislados y usa la acetilcolina. Está encargado de almacenar y conservar la energía. Es llamado también sistema colinérgico; ya que es el que mantiene al cuerpo en situaciones normales y luego de haber pasado la situación de estrés es antagónico al simpático.
Sistema nervioso entérico: Se encarga de controlar directamente el sistema gastrointestinal.6 El SNE consiste en cien millones de neuronas,7 (una milésima parte del número de neuronas en el cerebro, y bastante más que el número de neuronas en la médula espinal8 ) las cuales revisten el sistema gastrointestinal.
El sistema nervioso autónomo lo componen raíces, plexos y troncos nerviosos:
Raíces
Raíces cervicales
Raíces torácicas = Raíces dorsales
Raíces lumbares
Raíces sacras
Plexos
Plexo braquial
Plexo lumbosacro
Nervio
Pares craneales
Nervios de miembros superiores
Nervios de miembros inferiores
El sistema nervioso autónomo (SNA), también conocido como sistema nervioso vegetativo, es la parte del sistema nervioso que controla las acciones involuntarias,1 a diferencia del sistema nervioso somático. El sistema nervioso autónomo recibe la información de las vísceras y del medio interno, para actuar sobre sus músculos, glándulas y vasos sanguíneos.
El sistema nervioso autónomo es sobre todo un sistema eferente, es decir, transmite impulsos nerviosos desde el sistema nervioso central hasta la periferia estimulando los aparatos y sistemas órganos periféricos. Sus vías neuronales actúan sobre la frecuencia cardíaca y respiratoria, la contracción y dilatación de vasos sanguíneos, digestión, salivación, el sudor, la contracción y relajación del músculo liso en varios órganos, acomodación visual, tamaño de la pupila, secreción de glándulas exocrinas y endocrinas, la micción y la excitación sexual. La mayoría de las acciones del que controla son involuntarias, aunque algunas, como la respiración, actúan junto con acciones conscientes.2 El mal funcionamiento de este sistema puede provocar diversos síntomas, que se agrupan bajo el nombre genérico de disautonomía.
El sistema nervioso autónomo o neurovegetativo, al contrario del sistema nervioso somático y central, es involuntario activándose principalmente por centros nerviosos situados en la médula espinal, tallo cerebral e hipotálamo. También, algunas porciones de la corteza cerebral como la corteza límbica, pueden transmitir impulsos a los centros inferiores y así, influir en el control autónomo.3
Los nervios autónomos están formados por todas las fibras eferentes que abandonan el sistema nervioso central, excepto aquellas que inervan el músculo esquelético. Existen fibras autonómicas aferentes, que transmiten información desde la periferia al sistema nervioso central, encargándose de transmitir la sensación visceral y la regulación de reflejos vasomotores y respiratorios, por ejemplo los barorreceptores y quimiorreceptores del seno carotídeo y arco aórtico que son muy importantes en el control del ritmo cardíaco, presión sanguínea y movimientos respiratorios. Estas fibras aferentes son transportadas al sistema nervioso central por nervios autonómicos principales como el neumogástrico, nervios esplácnicos o nervios pélvicos.
También el sistema nervioso autónomo funciona a través de reflejos viscerales, es decir, las señales sensoriales que entran en los ganglios autónomos, la médula espinal, el tallo cerebral o el hipotálamo pueden originar respuestas reflejas adecuadas que son devueltas a los órganos para controlar su actividad.4 Reflejos simples terminan en los órganos correspondientes, mientras que reflejos más complejos son controlados por centros autonómicos superiores en el sistema nervioso central, principalmente el hipotálamo.
Estructura
El sistema nervioso vegetativo se divide funcionalmente en:
Sistema simpático: usa noradrenalina y adrenalina como neurotransmisor, y lo constituyen una cadena de ganglios paravertebrales situados a ambos lados de la columna vertebral que forman el llamado tronco simpático, así como unos ganglios prevertebrales o preaórticos, adosados a la cara anterior de la aorta (ganglios celíacos, aórtico-renales, mesentérico superior y mesentérico inferior). Está implicado en actividades que requieren gasto de energía. También es llamado sistema adrenérgico o noradrenérgico; ya que es el que prepara al cuerpo para reaccionar ante una situación de estrés.5
Sistema parasimpático: Lo forman los ganglios aislados y usa la acetilcolina. Está encargado de almacenar y conservar la energía. Es llamado también sistema colinérgico; ya que es el que mantiene al cuerpo en situaciones normales y luego de haber pasado la situación de estrés es antagónico al simpático.
Sistema nervioso entérico: Se encarga de controlar directamente el sistema gastrointestinal.6 El SNE consiste en cien millones de neuronas,7 (una milésima parte del número de neuronas en el cerebro, y bastante más que el número de neuronas en la médula espinal8 ) las cuales revisten el sistema gastrointestinal.
El sistema nervioso autónomo lo componen raíces, plexos y troncos nerviosos:
Raíces
Raíces cervicales
Raíces torácicas = Raíces dorsales
Raíces lumbares
Raíces sacras
Plexos
Plexo braquial
Plexo lumbosacro
Nervio
Pares craneales
Nervios de miembros superiores
Nervios de miembros inferiores
Corteza Cerebral
Corteza Cerebral
La corteza cerebral es el manto de tejido nervioso que cubre la superficie de los hemisferios cerebrales, alcanzando su máximo desarrollo en los primates. Es aquí donde ocurre la percepción, la imaginación, el pensamiento, el juicio y la decisión. Es ante todo una delgada capa de la materia gris –normalmente de 6 capas de espesor, de hecho por encima de una amplia colección de vías de materia blanca. La delgada capa está fuertemente circunvolucionada, por lo que si se extendiese, ocuparía unos 2500 cm². Esta capa incluye unos 10.000 millones de neuronas, con cerca de 50 trillones de sinapsis. Tales redes neuronales en la corteza macroscópicamente (a simple vista) se observan como materia gris. Tanto desde el punto de vista estructural como filogenético, se distinguen tres tipos básicos de corteza:

Localización de la corteza cerebral.
La corteza cerebral es el manto de tejido nervioso que cubre la superficie de los hemisferios cerebrales, alcanzando su máximo desarrollo en los primates. Es aquí donde ocurre la percepción, la imaginación, el pensamiento, el juicio y la decisión. Es ante todo una delgada capa de la materia gris –normalmente de 6 capas de espesor, de hecho por encima de una amplia colección de vías de materia blanca. La delgada capa está fuertemente circunvolucionada, por lo que si se extendiese, ocuparía unos 2500 cm². Esta capa incluye unos 10.000 millones de neuronas, con cerca de 50 trillones de sinapsis. Tales redes neuronales en la corteza macroscópicamente (a simple vista) se observan como materia gris. Tanto desde el punto de vista estructural como filogenético, se distinguen tres tipos básicos de corteza:

- Isocorteza (o neocorteza), que es el último en aparecer en la evolución del cerebro, es el encargado de los procesos de raciocinio, es, por así decirlo la parte del cerebro consciente.
- Paleocorteza, se origina en la corteza olfativa.
- Arquicorteza, constituido por la formación del hipocampo, esta es la parte "animal" o instintiva, la parte del cerebro que se encarga de la supervivencia, las reacciones automáticas y los procesos fisiológicos.
- El lóbulo temporal contiene neuronas que captan cualidades sonoras en la corteza auditiva primaria. También contiene neuronas relacionadas con la comprensión del lenguaje, memoria y aprendizaje.
- El lóbulo frontal contiene principalmente la corteza motora primaria, en la cual se encuentran las neuronas que controlan los músculos del cuerpo. Está organizada en función de las partes del cuerpo.
- El lóbulo parietal aloja a la corteza somatosensorial primaria, compuesta por neuronas relacionadas con el tacto, también se organiza en función de las partes del cuerpo.
- El lóbulo occipital contiene la corteza visual primaria, localizada en la parte posterior, procesa la información visual que llega de la retina.
jueves, 27 de septiembre de 2012
Sinapsis.
Ver archivo.

La sinapsis es una unión intercelular especializada entre neuronas1 o entre una neurona y una célula efectora (casi siempre glandular o muscular). En estos contactos se lleva a cabo la transmisión del impulso nervioso. Éste se inicia con una descarga química que origina una corriente eléctrica en la membrana de la célula presináptica (célula emisora); una vez que este impulso nervioso alcanza el extremo del axón (la conexión con la otra célula), la propia neurona segrega un tipo de compuestos químicos (neurotransmisores) que se depositan en el espacio sináptico (espacio intermedio entre esta neurona transmisora y la neurona postsináptica o receptora). Estas sustancias segregadas o neurotransmisores (noradrenalina y acetilcolina entre otros) son los encargados de excitar o inhibir la acción de la otra célula llamada célula post sináptica.
Índice
Origen de la palabra
La palabra sinapsis viene de sinapteína, que Sir Charles Scott Sherrington y colaboradores formaron con las palabras griegas sin-, que significa "juntos", y hapteina, es decir "con firmeza".
Marco de actividad
Estos enlaces químico-eléctricos están especializados en el envío de cierto tipo de señales de pervivencia, las cuales afectan a otras neuronas, a células no neuronales como las musculares o glandulares.
Existen dos tipos de actividad base distinta, la actividad de pervivencia y la actividad de supervivencia.
La actividad sináptica de pervivencia se desarrolla en estos contextos:
Entre dos neuronas: al estímulo lo portan los neurotransmisores de tipo aminoácido.
Entre una neurona y una célula muscular: al estímulo lo portan los neurotransmisores de tipo éster.
Entre una neurona y una célula secretora: al estímulo lo portan los neurotransmisores de tipo neuropéptido.
La actividad sináptica de supervivencia se desarrolla en estos contextos:
En la actividad procreadora.
En la actividad de consumo alimenticio.
En la actividad de conservación homeostática extrema.
La sinapsis se produce en el momento en que se registra actividad químico-eléctrica presináptica y otra postsináptica. Si esta condición no se da, no se puede hablar de sinapsis." En dicha acción se liberan neurotransmisores" ionizados con base química, cuya cancelación de carga provoca la activación de receptores específicos que, a su vez, generan otro tipo de respuestas químico-eléctricas.
Cada neurona se comunica, al menos, con otras mil neuronas y puede recibir, simultáneamente, hasta diez veces más conexiones de otras. Se estima que en el cerebro humano adulto hay por lo menos 1014 conexiones sinápticas (aproximadamente, entre 100 y 500 billones). En niños alcanza los 1000 billones. Este número disminuye con el paso de los años, estabilizándose en la edad adulta.[cita requerida]
Las sinapsis permiten a las neuronas del sistema nervioso central formar una red de circuitos neuronales. Son cruciales para los procesos biológicos que subyacen bajo la percepción y el pensamiento. También son el sistema mediante el cual el sistema nervioso conecta y controla todos los sistemas del cuerpo.
Sinapsis tripartita
De acuerdo con las últimas investigaciones relacionadas con los astrocitos, esta sinapsis constaría de tres elementos: los pre y postsinápticos neuronales y los astrocitos cercanos, que funcionarían como reguladores en la transferencia de información en el interior del sistema nervioso.
Histología
Axón terminal
Dendrita
Soma
Axón
Núcleo
Nodo de
Ranvier
Axón terminal
Célula de Schwann
Vaina de mielina
Estructura de una neurona clásica
Desde el punto de vista histológico y funcional, una neurona tiene tres zonas principales: el cuerpo o soma, las dendritas y el axón. Estos dos últimos elementos son los encargados de establecer las relaciones sinápticas: las dendritas son como antenas o tentáculos que reciben la mayoría de la información que proviene de otras células; el axón, por su parte, es el cable con el que una neurona se conecta a otras.
Las conexiones pueden establecerse a muy corto alcance, a unos cientos de micrómetros a la redonda, o a distancias mucho mayores. La moto neuronas de la espina dorsal, por ejemplo, se comunican directamente con órganos como los músculos para dar lugar al movimiento (sinapsis neuromuscular).
Una sinapsis prototípica, como las que aparecen en los botones dendríticos, consiste en unas proyecciones citoplasmáticas con forma de hongo desde cada célula que, al juntarse, los extremos de ambas se aplastan uno contra otro. En esta zona, las membranas celulares de ambas células se juntan en una unión estrecha que permite a las moléculas de señal llamadas neurotransmisores pasar rápidamente de una a otra célula por difusión. El canal de unión de la neurona postsináptica es de aproximadamente 20 nm de ancho, y se conoce como hendidura sináptica.
Estas sinapsis son asimétricas tanto en su estructura como en su funcionamiento. Sólo la neurona presináptica segrega los neurotransmisores, que se unen a los receptores transmembrana que la célula postsináptica tiene en la hendidura. El terminal nervioso presináptico (también llamado botón sináptico o botón) normalmente emerge del extremo de un axón, mientras que la zona postsináptica normalmente corresponde a una dendrita, al cuerpo celular o a otras zonas celulares. La zona de la sinapsis donde se libera el neurotransmisor se denomina zona activa. En las zonas activas, las membranas de las dos células adyacentes están unidas estrechamente mediante proteínas de adhesión celular. Justo tras la membrana de la célula postsináptica aparece un complejo de proteínas entrelazadas denominado densidad postsináptica. Las proteínas de la densidad postsináptica cumplen numerosas funciones, que van desde el anclaje y movimiento de receptores de neurotransmisores de la membrana plasmática, hasta el anclaje de varias proteínas reguladoras de la actividad de estos receptores.
Tipos de sinapsis
Sinapsis eléctrica
Esquema de una sinapsis eléctrica A-B: (1) mitocondria; (2) uniones gap formadas por conexinas; (3) señal eléctrica.
Artículo principal: Sinapsis eléctrica.
Una sinapsis eléctrica es aquella en la que la transmisión entre la primera neurona y la segunda no se produce por la secreción de un neurotransmisor, como en las sinapsis químicas (véase más abajo), sino por el paso de iones de una célula a otra a través de uniones gap, pequeños canales formados por el acoplamiento de complejos proteicos, basados en conexinas, en células estrechamente adheridas.
Las sinapsis eléctricas son más rápidas que las sinapsis químicas pero menos plásticas; por lo demás, son menos propensas a alteraciones o modulación porque facilitan el intercambio entre los citoplasmas de iones y otras sustancias químicas. En los vertebrados son comunes en el corazón y el hígado.
Las sinapsis eléctricas tienen tres ventajas muy importantes:
Las sinapsis eléctricas poseen una transmisión bidireccional de los potenciales de acción, en cambio la sinapsis química solo posee la comunicación unidireccional.
En la sinapsis eléctricas hay una sincronización en la actividad neuronal lo cual hace posible una coordinada acción entre ellas.
La comunicación es más rápida en la sinapsis eléctricas que en las químicas, debido a que los potenciales de acción pasan a través del canal proteico directamente sin necesidad de la liberación de los neurotransmisores.
Sinapsis química
La sinapsis química se establece entre células que están separadas entre sí por un espacio de unos 20-30 nanómetros(nm), la llamada hendidura sináptica.
La liberación de neurotransmisores es iniciada por la llegada de un impulso nervioso (o potencial de acción), y se produce mediante un proceso muy rápido de secreción celular: en el terminal nervioso presináptico, las vesículas que contienen los neurotransmisores permanecen ancladas y preparadas junto a la membrana sináptica. Cuando llega un potencial de acción se produce una entrada de iones calcio a través de los canales de calcio dependientes de voltaje. Los iones de calcio inician una cascada de reacciones que terminan haciendo que las membranas vesiculares se fusionen con la membrana presináptica y liberando su contenido a la hendidura sináptica. Los receptores del lado opuesto de la hendidura se unen a los neurotransmisores y fuerzan la apertura de los canales iónicos cercanos de la membrana postsináptica, haciendo que los iones fluyan hacia o desde el interior, cambiando el potencial de membrana local. El resultado es excitatorio en caso de flujos de despolarización, o inhibitorio en caso de flujos de hiperpolarización. El que una sinapsis sea excitatoria o inhibitoria depende del tipo o tipos de iones que se canalizan en los flujos postsinápticos, que a su vez es función del tipo de receptores y neurotransmisores que intervienen en la sinapsis.
La suma de los impulsos excitatorios e inhibitorios que llegan por todas las sinapsis que se relacionan con cada neurona (1000 a 200.000) determina si se produce o no la descarga del potencial de acción por el axón de esa neurona.
Clases de transmisión sináptica
Se distinguen tres tipos principales de transmisión sináptica; los dos primeros mecanismos constituyen las fuerzas principales que rigen en los circuitos neuronales:
transmisión excitadora: aquella que incrementa la posibilidad de producir un potencial de acción;
transmisión inhibidora: aquella que reduce la posibilidad de producir un potencial de acción;
transmisión moduladora: aquella que cambia el patrón y/o la frecuencia de la actividad producida por las células involucradas.
Fuerza sináptica
La fuerza de una sinapsis viene dada por el cambio del potencial de membrana que ocurre cuando se activan los receptores de neurotransmisores postsinápticos. Este cambio de voltaje se denomina potencial postsináptico, y es resultado directo de los flujos iónicos a través de los canales receptores postsinápticos. Los cambios en la fuerza sináptica pueden ser a corto plazo y sin cambios permanentes en las estructuras neuronales, con una duración de segundos o minutos, o de larga duración (potenciación a largo plazo o LTP), en que la activación continuada o repetida de la sinapsis implica que los segundos mensajeros inducen la síntesis proteica en el núcleo de la neurona, alterando la estructura de la propia neurona. El aprendizaje y la memoria podrían ser resultado de cambios a largo plazo en la fuerza sináptica, mediante un mecanismo de plasticidad sináptica.
Integración de señales sinápticas
Despolarización en una célula excitable, causada por una respuesta sináptica.
Generalmente, si una sinapsis excitatoria es fuerte, un potencial de acción en la neurona presináptica iniciará otro potencial en la célula postsináptica. En una sinapsis débil, el potencial excitatorio postsináptico ("PEPS") no alcanzará el umbral para la iniciación del potencial de acción. En el cerebro, cada neurona mantiene conexiones o sinapsis con muchas otras, pudiendo recibir cada una de ellas múltiples señales. Cuando se disparan potenciales de acción simultáneamente en varias neuronas que se unen en sinapsis débiles a otra neurona, pueden forzar el inicio de un impulso en esa célula a pesar de que las sinapsis son débiles.
Por otro lado, una neurona presináptica que libera neurotransmisores inhibitorios, como el GABA, puede generar un potencial inhibitorio postsináptico ("PIPS") en la neurona postsináptica, bajando su sensibilidad y la probabilidad de que se genere un potencial de acción en ella. Así la respuesta de una neurona depende de las señales que recibe de otras, con las que puede tener distintos grados de influencia, dependiendo de la fuerza de la sinapsis con esa neurona. John Carew Eccles realizó algunos experimentos importantes en los inicios de la investigación sináptica, por los que recibió el Premio Nobel de Fisiología o Medicina en 1963. Las complejas relaciones de entrada/salida conforman las bases de la computación basada en transistores, y se cree que funcionan de forma similar en los circuitos neuronales.
Propiedades y regulación
Tras la fusión de las vesículas sinápticas y la liberación de las moléculas transmisoras en la hendidura sináptica, el neurotransmisor es rápidamente eliminado del espacio por proteínas especializadas en su reciclaje, situadas en las membranas tanto presináptica como postsináptica. Esta recaptación evita la desensibilización de los receptores postsinápticos y asegura que los potenciales de acción subsiguientes generen un PEP de la misma intensidad. La necesidad de una recaptación y el fenómeno de la desensibilización en los receptores y canales iónicos significa que la fuerza de la sinapsis puede disminuir si un tren de potenciales de acción llega en una sucesión rápida, un fenómeno que hace que exista una dependencia de la frecuencia en las sinapsis. El sistema nervioso se aprovecha de esta propiedad para computaciones, y puede ajustar las sinapsis mediante la fosforilación de las proteínas implicadas. El tamaño, número y tasa de reposición de las vesículas también está sujeto a regulación, así como otros muchos aspectos de la transmisión sináptica. Por ejemplo, un tipo de fármaco conocido como inhibidores selectivos de la recaptación de serotonina o SSRI afectan a ciertas sinapsis inhibiendo la recaptación del neurotransmisor serotonina. Por el contrario, un neurotransmisor excitatorio muy importante, la acetilcolina, no es recaptada, pero es eliminada por acción de la enzima acetilcolinesterasa.

La sinapsis es una unión intercelular especializada entre neuronas1 o entre una neurona y una célula efectora (casi siempre glandular o muscular). En estos contactos se lleva a cabo la transmisión del impulso nervioso. Éste se inicia con una descarga química que origina una corriente eléctrica en la membrana de la célula presináptica (célula emisora); una vez que este impulso nervioso alcanza el extremo del axón (la conexión con la otra célula), la propia neurona segrega un tipo de compuestos químicos (neurotransmisores) que se depositan en el espacio sináptico (espacio intermedio entre esta neurona transmisora y la neurona postsináptica o receptora). Estas sustancias segregadas o neurotransmisores (noradrenalina y acetilcolina entre otros) son los encargados de excitar o inhibir la acción de la otra célula llamada célula post sináptica.
Índice
Origen de la palabra
La palabra sinapsis viene de sinapteína, que Sir Charles Scott Sherrington y colaboradores formaron con las palabras griegas sin-, que significa "juntos", y hapteina, es decir "con firmeza".
Marco de actividad
Estos enlaces químico-eléctricos están especializados en el envío de cierto tipo de señales de pervivencia, las cuales afectan a otras neuronas, a células no neuronales como las musculares o glandulares.
Existen dos tipos de actividad base distinta, la actividad de pervivencia y la actividad de supervivencia.
La actividad sináptica de pervivencia se desarrolla en estos contextos:
Entre dos neuronas: al estímulo lo portan los neurotransmisores de tipo aminoácido.
Entre una neurona y una célula muscular: al estímulo lo portan los neurotransmisores de tipo éster.
Entre una neurona y una célula secretora: al estímulo lo portan los neurotransmisores de tipo neuropéptido.
La actividad sináptica de supervivencia se desarrolla en estos contextos:
En la actividad procreadora.
En la actividad de consumo alimenticio.
En la actividad de conservación homeostática extrema.
La sinapsis se produce en el momento en que se registra actividad químico-eléctrica presináptica y otra postsináptica. Si esta condición no se da, no se puede hablar de sinapsis." En dicha acción se liberan neurotransmisores" ionizados con base química, cuya cancelación de carga provoca la activación de receptores específicos que, a su vez, generan otro tipo de respuestas químico-eléctricas.
Cada neurona se comunica, al menos, con otras mil neuronas y puede recibir, simultáneamente, hasta diez veces más conexiones de otras. Se estima que en el cerebro humano adulto hay por lo menos 1014 conexiones sinápticas (aproximadamente, entre 100 y 500 billones). En niños alcanza los 1000 billones. Este número disminuye con el paso de los años, estabilizándose en la edad adulta.[cita requerida]
Las sinapsis permiten a las neuronas del sistema nervioso central formar una red de circuitos neuronales. Son cruciales para los procesos biológicos que subyacen bajo la percepción y el pensamiento. También son el sistema mediante el cual el sistema nervioso conecta y controla todos los sistemas del cuerpo.
Sinapsis tripartita
De acuerdo con las últimas investigaciones relacionadas con los astrocitos, esta sinapsis constaría de tres elementos: los pre y postsinápticos neuronales y los astrocitos cercanos, que funcionarían como reguladores en la transferencia de información en el interior del sistema nervioso.
Histología
Axón terminal
Dendrita
Soma
Axón
Núcleo
Nodo de
Ranvier
Axón terminal
Célula de Schwann
Vaina de mielina
Estructura de una neurona clásica
| Axón terminal |
|---|
 |
Desde el punto de vista histológico y funcional, una neurona tiene tres zonas principales: el cuerpo o soma, las dendritas y el axón. Estos dos últimos elementos son los encargados de establecer las relaciones sinápticas: las dendritas son como antenas o tentáculos que reciben la mayoría de la información que proviene de otras células; el axón, por su parte, es el cable con el que una neurona se conecta a otras.
Las conexiones pueden establecerse a muy corto alcance, a unos cientos de micrómetros a la redonda, o a distancias mucho mayores. La moto neuronas de la espina dorsal, por ejemplo, se comunican directamente con órganos como los músculos para dar lugar al movimiento (sinapsis neuromuscular).
Una sinapsis prototípica, como las que aparecen en los botones dendríticos, consiste en unas proyecciones citoplasmáticas con forma de hongo desde cada célula que, al juntarse, los extremos de ambas se aplastan uno contra otro. En esta zona, las membranas celulares de ambas células se juntan en una unión estrecha que permite a las moléculas de señal llamadas neurotransmisores pasar rápidamente de una a otra célula por difusión. El canal de unión de la neurona postsináptica es de aproximadamente 20 nm de ancho, y se conoce como hendidura sináptica.
Estas sinapsis son asimétricas tanto en su estructura como en su funcionamiento. Sólo la neurona presináptica segrega los neurotransmisores, que se unen a los receptores transmembrana que la célula postsináptica tiene en la hendidura. El terminal nervioso presináptico (también llamado botón sináptico o botón) normalmente emerge del extremo de un axón, mientras que la zona postsináptica normalmente corresponde a una dendrita, al cuerpo celular o a otras zonas celulares. La zona de la sinapsis donde se libera el neurotransmisor se denomina zona activa. En las zonas activas, las membranas de las dos células adyacentes están unidas estrechamente mediante proteínas de adhesión celular. Justo tras la membrana de la célula postsináptica aparece un complejo de proteínas entrelazadas denominado densidad postsináptica. Las proteínas de la densidad postsináptica cumplen numerosas funciones, que van desde el anclaje y movimiento de receptores de neurotransmisores de la membrana plasmática, hasta el anclaje de varias proteínas reguladoras de la actividad de estos receptores.
Tipos de sinapsis
Sinapsis eléctrica
Esquema de una sinapsis eléctrica A-B: (1) mitocondria; (2) uniones gap formadas por conexinas; (3) señal eléctrica.
Artículo principal: Sinapsis eléctrica.
Una sinapsis eléctrica es aquella en la que la transmisión entre la primera neurona y la segunda no se produce por la secreción de un neurotransmisor, como en las sinapsis químicas (véase más abajo), sino por el paso de iones de una célula a otra a través de uniones gap, pequeños canales formados por el acoplamiento de complejos proteicos, basados en conexinas, en células estrechamente adheridas.
Las sinapsis eléctricas son más rápidas que las sinapsis químicas pero menos plásticas; por lo demás, son menos propensas a alteraciones o modulación porque facilitan el intercambio entre los citoplasmas de iones y otras sustancias químicas. En los vertebrados son comunes en el corazón y el hígado.
Las sinapsis eléctricas tienen tres ventajas muy importantes:
Las sinapsis eléctricas poseen una transmisión bidireccional de los potenciales de acción, en cambio la sinapsis química solo posee la comunicación unidireccional.
En la sinapsis eléctricas hay una sincronización en la actividad neuronal lo cual hace posible una coordinada acción entre ellas.
La comunicación es más rápida en la sinapsis eléctricas que en las químicas, debido a que los potenciales de acción pasan a través del canal proteico directamente sin necesidad de la liberación de los neurotransmisores.
Sinapsis química
La sinapsis química se establece entre células que están separadas entre sí por un espacio de unos 20-30 nanómetros(nm), la llamada hendidura sináptica.
La liberación de neurotransmisores es iniciada por la llegada de un impulso nervioso (o potencial de acción), y se produce mediante un proceso muy rápido de secreción celular: en el terminal nervioso presináptico, las vesículas que contienen los neurotransmisores permanecen ancladas y preparadas junto a la membrana sináptica. Cuando llega un potencial de acción se produce una entrada de iones calcio a través de los canales de calcio dependientes de voltaje. Los iones de calcio inician una cascada de reacciones que terminan haciendo que las membranas vesiculares se fusionen con la membrana presináptica y liberando su contenido a la hendidura sináptica. Los receptores del lado opuesto de la hendidura se unen a los neurotransmisores y fuerzan la apertura de los canales iónicos cercanos de la membrana postsináptica, haciendo que los iones fluyan hacia o desde el interior, cambiando el potencial de membrana local. El resultado es excitatorio en caso de flujos de despolarización, o inhibitorio en caso de flujos de hiperpolarización. El que una sinapsis sea excitatoria o inhibitoria depende del tipo o tipos de iones que se canalizan en los flujos postsinápticos, que a su vez es función del tipo de receptores y neurotransmisores que intervienen en la sinapsis.
La suma de los impulsos excitatorios e inhibitorios que llegan por todas las sinapsis que se relacionan con cada neurona (1000 a 200.000) determina si se produce o no la descarga del potencial de acción por el axón de esa neurona.
Clases de transmisión sináptica
Se distinguen tres tipos principales de transmisión sináptica; los dos primeros mecanismos constituyen las fuerzas principales que rigen en los circuitos neuronales:
transmisión excitadora: aquella que incrementa la posibilidad de producir un potencial de acción;
transmisión inhibidora: aquella que reduce la posibilidad de producir un potencial de acción;
transmisión moduladora: aquella que cambia el patrón y/o la frecuencia de la actividad producida por las células involucradas.
Fuerza sináptica
La fuerza de una sinapsis viene dada por el cambio del potencial de membrana que ocurre cuando se activan los receptores de neurotransmisores postsinápticos. Este cambio de voltaje se denomina potencial postsináptico, y es resultado directo de los flujos iónicos a través de los canales receptores postsinápticos. Los cambios en la fuerza sináptica pueden ser a corto plazo y sin cambios permanentes en las estructuras neuronales, con una duración de segundos o minutos, o de larga duración (potenciación a largo plazo o LTP), en que la activación continuada o repetida de la sinapsis implica que los segundos mensajeros inducen la síntesis proteica en el núcleo de la neurona, alterando la estructura de la propia neurona. El aprendizaje y la memoria podrían ser resultado de cambios a largo plazo en la fuerza sináptica, mediante un mecanismo de plasticidad sináptica.
Integración de señales sinápticas
Despolarización en una célula excitable, causada por una respuesta sináptica.
Generalmente, si una sinapsis excitatoria es fuerte, un potencial de acción en la neurona presináptica iniciará otro potencial en la célula postsináptica. En una sinapsis débil, el potencial excitatorio postsináptico ("PEPS") no alcanzará el umbral para la iniciación del potencial de acción. En el cerebro, cada neurona mantiene conexiones o sinapsis con muchas otras, pudiendo recibir cada una de ellas múltiples señales. Cuando se disparan potenciales de acción simultáneamente en varias neuronas que se unen en sinapsis débiles a otra neurona, pueden forzar el inicio de un impulso en esa célula a pesar de que las sinapsis son débiles.
Por otro lado, una neurona presináptica que libera neurotransmisores inhibitorios, como el GABA, puede generar un potencial inhibitorio postsináptico ("PIPS") en la neurona postsináptica, bajando su sensibilidad y la probabilidad de que se genere un potencial de acción en ella. Así la respuesta de una neurona depende de las señales que recibe de otras, con las que puede tener distintos grados de influencia, dependiendo de la fuerza de la sinapsis con esa neurona. John Carew Eccles realizó algunos experimentos importantes en los inicios de la investigación sináptica, por los que recibió el Premio Nobel de Fisiología o Medicina en 1963. Las complejas relaciones de entrada/salida conforman las bases de la computación basada en transistores, y se cree que funcionan de forma similar en los circuitos neuronales.
Propiedades y regulación
Tras la fusión de las vesículas sinápticas y la liberación de las moléculas transmisoras en la hendidura sináptica, el neurotransmisor es rápidamente eliminado del espacio por proteínas especializadas en su reciclaje, situadas en las membranas tanto presináptica como postsináptica. Esta recaptación evita la desensibilización de los receptores postsinápticos y asegura que los potenciales de acción subsiguientes generen un PEP de la misma intensidad. La necesidad de una recaptación y el fenómeno de la desensibilización en los receptores y canales iónicos significa que la fuerza de la sinapsis puede disminuir si un tren de potenciales de acción llega en una sucesión rápida, un fenómeno que hace que exista una dependencia de la frecuencia en las sinapsis. El sistema nervioso se aprovecha de esta propiedad para computaciones, y puede ajustar las sinapsis mediante la fosforilación de las proteínas implicadas. El tamaño, número y tasa de reposición de las vesículas también está sujeto a regulación, así como otros muchos aspectos de la transmisión sináptica. Por ejemplo, un tipo de fármaco conocido como inhibidores selectivos de la recaptación de serotonina o SSRI afectan a ciertas sinapsis inhibiendo la recaptación del neurotransmisor serotonina. Por el contrario, un neurotransmisor excitatorio muy importante, la acetilcolina, no es recaptada, pero es eliminada por acción de la enzima acetilcolinesterasa.
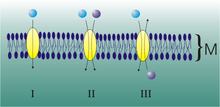
Transporte a través de Membrana.
Click aquí para ver el archivo.
Transporte a través de la membrana celular o plasmática
El proceso de transporte es importante para la célula porque le permite expulsar de su interior los desechos del metabolismo, también sustancias que sintetiza como hormonas y además, es forma en que adquiere nutrientes del medio externo, gracias a la capacidad de la membrana celular de permitir el paso o salida de manera selectiva de algunas sustancias. Las vías de transporte a través de la membrana celular y los mecanismos básicos para las moléculas de pequeño tamaño son:
Transporte pasivo
Transporte simple de moléculas a través de la membrana plasmática, durante el cual la célula no requiere usar energía, debido a que va a favor del gradiente de concentración o del gradiente de carga eléctrica. Hay tres tipos de transporte pasivo:
Ósmosis: (transporte de moléculas de agua solvente) a través de la membrana plasmática a favor de su gradiente de concentración.
Difusión simple: paso de sustancias a través de la membrana plasmática como los gases respiratorios y el alcohol.(movimiento de solutos)
Difusión facilitada: transporte celular donde es necesaria la presencia de un carrier o transportador (proteína periférica) para que las sustancias atraviesen la membrana.
Mediante la bicapa lipídica.
Mediante los canales iónicos.
Ósmosis



Comportamiento de célula animal ante distintas presiones osmoticas
Comportamiento de célula vegetal ante distintas presiones osmoticas
La ósmosis es un tipo especial de transporte pasivo en el cual sólo las moléculas de agua son transportadas a través de la membrana. El movimiento de agua se realiza desde el punto en que hay menor concentración de solutos al de mayor concentración para igualar concentraciones en ambos extremos de la membrana bicapa fosfolipidica. De acuerdo al medio en que se encuentre una célula, la ósmosis varía. La función de la ósmosis es mantener hidratada a la membrana celular. Dicho proceso no requiere gasto de energía. En otras palabras, la ósmosis es un fenómeno consistente en el paso del solvente de una disolución desde una zona de baja concentración de soluto a una de alta concentración del soluto, separadas por una membrana semipermeable.
Ósmosis en una célula animal
En un medio isotónico, hay un equilibrio dinámico, es decir, el paso constante de agua.
En un medio hipotónico, la célula absorbe agua hinchándose y hasta el punto en que puede estallar dando origen a la citólisis.
En un medio hipertónico, la célula pierde agua, se arruga llegando a deshidratarse y se muere, esto se llama crenación.
Ósmosis en una célula vegetal
En un medio isotónico, existe un equilibrio dinámico.
En un medio hipotónico, la célula toma agua y sus vacuolas se llenan aumentando la presión de turgencia, dando lugar a la turgencia.
En un medio hipertónico, la célula elimina agua y el volumen de la vacuola disminuye, produciendo que la membrana plasmática se despegue de la pared celular, ocurriendo la plasmólisis
Difusión facilitada
Algunas moléculas son demasiado grandes como para difundir a través de los canales de la membrana y demasiado hidrofílicos para poder difundir a través de la capa de fosfolípidos y colesterol. Tal es el caso de la glucosa y algunos otros monosacáridos.
Estas sustancias, pueden sin embargo cruzar la membrana plasmática mediante el proceso de difusión facilitada, con la ayuda de una proteína transportadora. En el primer paso, la glucosa se une a la proteína transportadora, y esta cambia de forma, permitiendo el paso del azúcar. Tan pronto como la glucosa llega al citoplasma, una quinasa (enzima que añade un grupo fosfato a un azúcar) transforma la glucosa en glucosa-6-fosfato. De esta forma, las concentraciones de glucosa en el interior de la célula son siempre muy bajas, y el gradiente de concentración exterior → interior favorece la difusión de la glucosa.
La difusión facilitada es mucho más rápida que la difusión simple y depende:
Del gradiente de concentración de la sustancia a ambos lados de la membrana
Del número de proteínas transportadoras existentes en la membrana
De la rapidez con que estas proteínas hacen su trabajo
Transporte activo
Es un mecanismo que permite a la célula transportar sustancias disueltas a través de su membrana desde regiones de menor concentración a otras de mayor concentración. Es un proceso que requiere energía, llamado también producto activo debido al movimiento absorbente de partículas que es un proceso de energía para requerir que mueva el material a través de una membrana de la célula y sube el gradiente de la concentración. La célula utiliza transporte activo en tres situaciones:
cuando una partícula va de punto bajo a la alta concentración.
cuando las partículas necesitan la ayuda que entra en la membrana porque son selectivamente impermeables.
cuando las partículas muy grandes incorporan y salen de la célula.
En la mayor parte de los casos este transporte activo se realiza a expensas de un gradiente de H+ (potencial electroquímico de protones) previamente creado a ambos lados de la membrana, por procesos de respiración y fotosíntesis; por hidrólisis de ATP mediante ATP hidrolasas de membrana. El transporte activo varía la concentración intracelular y ello da lugar un nuevo movimiento osmótico de rebalanceo por hidratación. Los sistemas de transporte activo son los más abundantes entre las bacterias, y se han seleccionado evolutivamente debido a que en sus medios naturales la mayoría de los procariotas se encuentran de forma permanente o transitoria con una baja concentración de nutrientes.
Los sistemas de transporte activo están basados en permeasas específicas e inducibles. El modo en que se acopla la energía metabólica con el transporte del soluto aún no está dilucidado, pero en general se maneja la hipótesis de que las permeasas, una vez captado el sustrato con gran afinidad, experimentan un cambio conformacional dependiente de energía que les hace perder dicha afinidad, lo que supone la liberación de la sustancia al interior celular.
El transporte activo de moléculas a través de la membrana celular se realiza en dirección ascendente o en contra de un gradiente de concentración (Gradiente químico) o en contra un gradiente eléctrico de presión (gradiente electroquímico), es decir, es el paso de sustancias desde un medio poco concentrado a un medio muy concentrado. Para desplazar estas sustancias contra corriente es necesario el aporte de energía procedente del ATP. Las proteínas portadoras del transporte activo poseen actividad ATPasa, que significa que pueden escindir el ATP (Adenosin Tri Fosfato) para formar ADP (dos Fosfatos) o AMP (un Fosfato) con liberación de energía de los enlaces fosfato de alta energía. Comúnmente se observan tres tipos de transportadores:
Uniportadores: son proteínas que transportan una molécula en un solo sentido a través de la membrana.
Antiportadores: incluyen proteínas que transportan una sustancia en un sentido mientras que simultáneamente transportan otra en sentido opuesto.
Simportadores: son proteínas que transportan una sustancia junto con otra, frecuentemente un protón (H+).
Transporte activo primario: Bomba de sodio y potasio
Artículo principal: Bomba sodio-potasio.
Se encuentra en todas las células del organismo, en cada ciclo consume una molécula de ATP y es la encargada de transportar 2 iones de potasio que logran ingresar a la célula, al mismo tiempo bombea 3 iones de sodio desde el interior hacia el exterior de la célula (exoplasma), ya que quimicamente tanto el sodio como el potasio poseen cargas positivas. El resultado es ingreso de 2 iones de potasio (Ingreso de 2 cargas positivas) y egreso de 3 iones de sodio (Egreso de 3 cargas positivas), esto da como resultado una perdida de la electropositividad interna de la célula, lo que convierte a su medio interno en un medio "electronegativo con respecto al medio extracelular". En caso particular de las neuronas en estado de reposo esta diferencia de cargas a ambos lados de la membrana se llama potencial de membrana o de reposo-descanso. Participa activamente en el impulso nervioso, ya que a través de ella se vuelve al estado de reposo.
Transporte activo secundario o cotransporte
Es el transporte de sustancias que normalmente no atraviesan la membrana celular tales como los aminoácidos y la glucosa, cuya energía requerida para el transporte deriva del gradiente de concentración de los iones sodio de la membrana celular (como el gradiente producido por el sistema glucosa/sodio del intestino delgado).
Intercambiador calcio-sodio: Es una proteína de la membrana celular de todas las células eucariotas. Su función consiste en transportar calcio iónico (Ca2+) hacia el exterior de la célula empleando para ello el gradiente de sodio; su finalidad es mantener la baja concentración de Ca2+ en el citoplasma que es unas diez mil veces menor que en el medio externo. Por cada catión Ca2+ expulsado por el intercambiador al medio extracelular penetran tres cationes Na+ al interior celular.1 Se sabe que las variaciones en la concentración intracelular del Ca2+ (segundo mensajero) se producen como respuesta a diversos estímulos y están involucradas en procesos como la contracción muscular, la expresión genética, la diferenciación celular, la secreción, y varias funciones de las neuronas. Dada la variedad de procesos metabólicos regulados por el Ca2+, un aumento de la concentración de Ca2+ en el citoplasma puede provocar un funcionamiento anormal de los mismos. Si el aumento de la concentración de Ca2+ en la fase acuosa del citoplasma se aproxima a un décimo de la del medio externo, el trastorno metabólico producido conduce a la muerte celular. El calcio es el mineral más abundante del organismo, además de cumplir múltiples funciones.
Transporte a través de la membrana celular o plasmática
El proceso de transporte es importante para la célula porque le permite expulsar de su interior los desechos del metabolismo, también sustancias que sintetiza como hormonas y además, es forma en que adquiere nutrientes del medio externo, gracias a la capacidad de la membrana celular de permitir el paso o salida de manera selectiva de algunas sustancias. Las vías de transporte a través de la membrana celular y los mecanismos básicos para las moléculas de pequeño tamaño son:
Transporte pasivo
Transporte simple de moléculas a través de la membrana plasmática, durante el cual la célula no requiere usar energía, debido a que va a favor del gradiente de concentración o del gradiente de carga eléctrica. Hay tres tipos de transporte pasivo:
Ósmosis: (transporte de moléculas de agua solvente) a través de la membrana plasmática a favor de su gradiente de concentración.
Difusión simple: paso de sustancias a través de la membrana plasmática como los gases respiratorios y el alcohol.(movimiento de solutos)
Difusión facilitada: transporte celular donde es necesaria la presencia de un carrier o transportador (proteína periférica) para que las sustancias atraviesen la membrana.
Mediante la bicapa lipídica.
Mediante los canales iónicos.
Ósmosis


Comportamiento de célula animal ante distintas presiones osmoticas
Comportamiento de célula vegetal ante distintas presiones osmoticas
La ósmosis es un tipo especial de transporte pasivo en el cual sólo las moléculas de agua son transportadas a través de la membrana. El movimiento de agua se realiza desde el punto en que hay menor concentración de solutos al de mayor concentración para igualar concentraciones en ambos extremos de la membrana bicapa fosfolipidica. De acuerdo al medio en que se encuentre una célula, la ósmosis varía. La función de la ósmosis es mantener hidratada a la membrana celular. Dicho proceso no requiere gasto de energía. En otras palabras, la ósmosis es un fenómeno consistente en el paso del solvente de una disolución desde una zona de baja concentración de soluto a una de alta concentración del soluto, separadas por una membrana semipermeable.
Ósmosis en una célula animal
En un medio isotónico, hay un equilibrio dinámico, es decir, el paso constante de agua.
En un medio hipotónico, la célula absorbe agua hinchándose y hasta el punto en que puede estallar dando origen a la citólisis.
En un medio hipertónico, la célula pierde agua, se arruga llegando a deshidratarse y se muere, esto se llama crenación.
Ósmosis en una célula vegetal
En un medio isotónico, existe un equilibrio dinámico.
En un medio hipotónico, la célula toma agua y sus vacuolas se llenan aumentando la presión de turgencia, dando lugar a la turgencia.
En un medio hipertónico, la célula elimina agua y el volumen de la vacuola disminuye, produciendo que la membrana plasmática se despegue de la pared celular, ocurriendo la plasmólisis
Difusión facilitada
Algunas moléculas son demasiado grandes como para difundir a través de los canales de la membrana y demasiado hidrofílicos para poder difundir a través de la capa de fosfolípidos y colesterol. Tal es el caso de la glucosa y algunos otros monosacáridos.
Estas sustancias, pueden sin embargo cruzar la membrana plasmática mediante el proceso de difusión facilitada, con la ayuda de una proteína transportadora. En el primer paso, la glucosa se une a la proteína transportadora, y esta cambia de forma, permitiendo el paso del azúcar. Tan pronto como la glucosa llega al citoplasma, una quinasa (enzima que añade un grupo fosfato a un azúcar) transforma la glucosa en glucosa-6-fosfato. De esta forma, las concentraciones de glucosa en el interior de la célula son siempre muy bajas, y el gradiente de concentración exterior → interior favorece la difusión de la glucosa.
La difusión facilitada es mucho más rápida que la difusión simple y depende:
Del gradiente de concentración de la sustancia a ambos lados de la membrana
Del número de proteínas transportadoras existentes en la membrana
De la rapidez con que estas proteínas hacen su trabajo
Transporte activo
Es un mecanismo que permite a la célula transportar sustancias disueltas a través de su membrana desde regiones de menor concentración a otras de mayor concentración. Es un proceso que requiere energía, llamado también producto activo debido al movimiento absorbente de partículas que es un proceso de energía para requerir que mueva el material a través de una membrana de la célula y sube el gradiente de la concentración. La célula utiliza transporte activo en tres situaciones:
cuando una partícula va de punto bajo a la alta concentración.
cuando las partículas necesitan la ayuda que entra en la membrana porque son selectivamente impermeables.
cuando las partículas muy grandes incorporan y salen de la célula.
En la mayor parte de los casos este transporte activo se realiza a expensas de un gradiente de H+ (potencial electroquímico de protones) previamente creado a ambos lados de la membrana, por procesos de respiración y fotosíntesis; por hidrólisis de ATP mediante ATP hidrolasas de membrana. El transporte activo varía la concentración intracelular y ello da lugar un nuevo movimiento osmótico de rebalanceo por hidratación. Los sistemas de transporte activo son los más abundantes entre las bacterias, y se han seleccionado evolutivamente debido a que en sus medios naturales la mayoría de los procariotas se encuentran de forma permanente o transitoria con una baja concentración de nutrientes.
Los sistemas de transporte activo están basados en permeasas específicas e inducibles. El modo en que se acopla la energía metabólica con el transporte del soluto aún no está dilucidado, pero en general se maneja la hipótesis de que las permeasas, una vez captado el sustrato con gran afinidad, experimentan un cambio conformacional dependiente de energía que les hace perder dicha afinidad, lo que supone la liberación de la sustancia al interior celular.
El transporte activo de moléculas a través de la membrana celular se realiza en dirección ascendente o en contra de un gradiente de concentración (Gradiente químico) o en contra un gradiente eléctrico de presión (gradiente electroquímico), es decir, es el paso de sustancias desde un medio poco concentrado a un medio muy concentrado. Para desplazar estas sustancias contra corriente es necesario el aporte de energía procedente del ATP. Las proteínas portadoras del transporte activo poseen actividad ATPasa, que significa que pueden escindir el ATP (Adenosin Tri Fosfato) para formar ADP (dos Fosfatos) o AMP (un Fosfato) con liberación de energía de los enlaces fosfato de alta energía. Comúnmente se observan tres tipos de transportadores:
Uniportadores: son proteínas que transportan una molécula en un solo sentido a través de la membrana.
Antiportadores: incluyen proteínas que transportan una sustancia en un sentido mientras que simultáneamente transportan otra en sentido opuesto.
Simportadores: son proteínas que transportan una sustancia junto con otra, frecuentemente un protón (H+).
Transporte activo primario: Bomba de sodio y potasio
Artículo principal: Bomba sodio-potasio.
Se encuentra en todas las células del organismo, en cada ciclo consume una molécula de ATP y es la encargada de transportar 2 iones de potasio que logran ingresar a la célula, al mismo tiempo bombea 3 iones de sodio desde el interior hacia el exterior de la célula (exoplasma), ya que quimicamente tanto el sodio como el potasio poseen cargas positivas. El resultado es ingreso de 2 iones de potasio (Ingreso de 2 cargas positivas) y egreso de 3 iones de sodio (Egreso de 3 cargas positivas), esto da como resultado una perdida de la electropositividad interna de la célula, lo que convierte a su medio interno en un medio "electronegativo con respecto al medio extracelular". En caso particular de las neuronas en estado de reposo esta diferencia de cargas a ambos lados de la membrana se llama potencial de membrana o de reposo-descanso. Participa activamente en el impulso nervioso, ya que a través de ella se vuelve al estado de reposo.
Transporte activo secundario o cotransporte
Es el transporte de sustancias que normalmente no atraviesan la membrana celular tales como los aminoácidos y la glucosa, cuya energía requerida para el transporte deriva del gradiente de concentración de los iones sodio de la membrana celular (como el gradiente producido por el sistema glucosa/sodio del intestino delgado).
Intercambiador calcio-sodio: Es una proteína de la membrana celular de todas las células eucariotas. Su función consiste en transportar calcio iónico (Ca2+) hacia el exterior de la célula empleando para ello el gradiente de sodio; su finalidad es mantener la baja concentración de Ca2+ en el citoplasma que es unas diez mil veces menor que en el medio externo. Por cada catión Ca2+ expulsado por el intercambiador al medio extracelular penetran tres cationes Na+ al interior celular.1 Se sabe que las variaciones en la concentración intracelular del Ca2+ (segundo mensajero) se producen como respuesta a diversos estímulos y están involucradas en procesos como la contracción muscular, la expresión genética, la diferenciación celular, la secreción, y varias funciones de las neuronas. Dada la variedad de procesos metabólicos regulados por el Ca2+, un aumento de la concentración de Ca2+ en el citoplasma puede provocar un funcionamiento anormal de los mismos. Si el aumento de la concentración de Ca2+ en la fase acuosa del citoplasma se aproxima a un décimo de la del medio externo, el trastorno metabólico producido conduce a la muerte celular. El calcio es el mineral más abundante del organismo, además de cumplir múltiples funciones.
domingo, 2 de septiembre de 2012
Transcripción y traducción de proteínas.
El siguiente es un trabajo acerca de la Transcripción y traducción de proteínas. 02/09/12
Click aquí, para ver y descargar el archivo.
INTRODUCCION
El ARN mensajero es el que lleva la información para la síntesis de proteínas, es decir, determina el orden en que se unirán los aminoácidos
La síntesis de proteínas o traducción tiene lugar en los ribosomas del citoplasma celular. Los aminoácidos son transportados por el ARN de transferencia (ARNt) , específico para cada uno de ellos, y son llevados hasta el ARN mensajero (ARNm), dónde se aparean el codón de éste y el anticodón del ARN de transferencia, por complementariedad de bases, y de ésta forma se sitúan en la posición que les corresponde.
Una vez finalizada la síntesis de una proteína, el ARN mensajero queda libre y puede ser leído de nuevo. De hecho, es muy frecuente que antes de que finalice una proteínaya está comenzando otra, con lo cual, una misma molécula de ARN mensajero, está siendo utilizada por varios ribosomassimultáneamente.
La síntesis de las proteínas comienza con la unión entre sí de dos aminoácidos y continúa por el agregado de nuevos aminoácidos -de a uno por vez- en uno extremos de la cadena.
Como se sabe la clave de la traducción reside en el código genético, compuesto por combinaciones de tres nucleótidos consecutivos -o tripletes- en el ARNm. Los distintos tripletes se relacionan específicamente con tipos de aminoácidos usados en la síntesis de las proteínas.
Cada triplete constituye un codón: existen en total 64 codones, 61 de los cuales sirven para cifrar aminoácidos y 3 para marcar el cese de la traducción. Tal cantidad deriva de una relación matemática simple: los cuatro nucleótidos (A, U, C y G)se combinan de a tres, por lo que pueden generarse 64 (43).
Dado que existen más codones, (61) que tipos de aminoácidos (20), casi todos pueden ser reconocidos por más de un codón, por lo que algunos tripletes a como "sinónimos". Solamente el triptófano y la metionina -dos de los aminoácidos menos frecuentes en las proteínas - son codificados, cada uno, por un solo codón
Fig. A-1. Los dibujos ilustran cuatro de los seis codones que codifican al aminoácido leucina (Leu). Los dos de la izquierda se aparean con un mismo anticodón, igual que el par de codones de la derecha. Ello es posible porque la tercera base de los codones suele ser "adaptable ", es decir, puede establecer uniones con una base no complementaria.

Generalmente los codones que representan a un mismo aminoácido se parecen entre sí y es frecuente que difieran sólo en el tercer nucleótido. La baja especificidad de este nucleótido ha llevado a decir que existe una "degeneración" en tercera base de la mayoría de los codones. Resta agregar que el número de codones en el ARNm determina la longitud de la proteína.
Cada tipo de ARNt lleva antepuesto el nombre del aminoácido que transporta. por ejemplo, leucinil-ARNt para el aminoacil-ARNt de la leucina, lisinil-ARNt para el de la lisina, fenilalanil-ARNt para el de la fenilalanina, metionil-ARNt para el de la metionina, etcétera.
Por su lado. El ARNt unido al aminoácido compatible con él se designa aminoacil-ARNtAA, en el que "AA" correspnde a la sigla del aminoácido. Por ejemplo, leucinil-ARNtLeu, lisinil-ARNtlys, fenilalanil-ARNtPhe. metionil-ARNtMet, etcétera.
Si bien teóricamente pueden existir 61 tipos de ARNt diferentes, sólo hay 31. El déficit se resuelve por la capacidad que tienen algunos ARNt de reconocer a más de un codón. Lo logran porque sus anticodones suelen poseer la primera base "adaptable", es decir, que puede unirse con una base no complementaria situada en la tercera posición del codón (recuérdese la "degeneración" de esta base).
Así, la G en la primera posición del anticodón puede aparearse tanto con una C -es lo habitual - como con una U del codón (fig. A-1). Similarmente, la U en la primera posición del anticodón puede hacerlo con una A -es lo habitual - o con una G. Por otra parte, la inosina (I) -una de las bases inusuales se encuentra en la primera posición del anticodón en varios ARNt y es capaz de aparearse con cualquier base (excepto con una G) localizada en la tercera posición del codón.
Al especificar el primer aminoácido de la proteína, el codón AUG de iniciación determina el encuadre de los sucesivos tripletes, lo que asegura la síntesis correcta de la molécula. Tómese como ejemplo la secuencia AUGGCCUGUAACGGU. Si el ARNm es traducido a partir del codón AUG, los codones
siguientes serán GCC, UGU, AAC y GGU, que codifican, respectivamente, a los aminoácidos alanina, cisteina ,asparagina y glicina. En cambio, si se omitiera la A del codón de iniciación, el encuadre de los tripletes sería el siguiente: UGG, CCU, GUA y ACG, los cuales se traducen en los aminoácidos triptófano, prolina, valina y treonina, respectivamente.
Algo semejante ocurriría si también se omitiera la U, pues resultaría un tercer tipo de encuadre: GGC, CUG, UAA y CGC. En este caso, después de codificar los dos primeros codones a los aminoácidos glicina y leucina, la traducción se detendría, ya que UAA es un codón de terminación.
Fig. A-2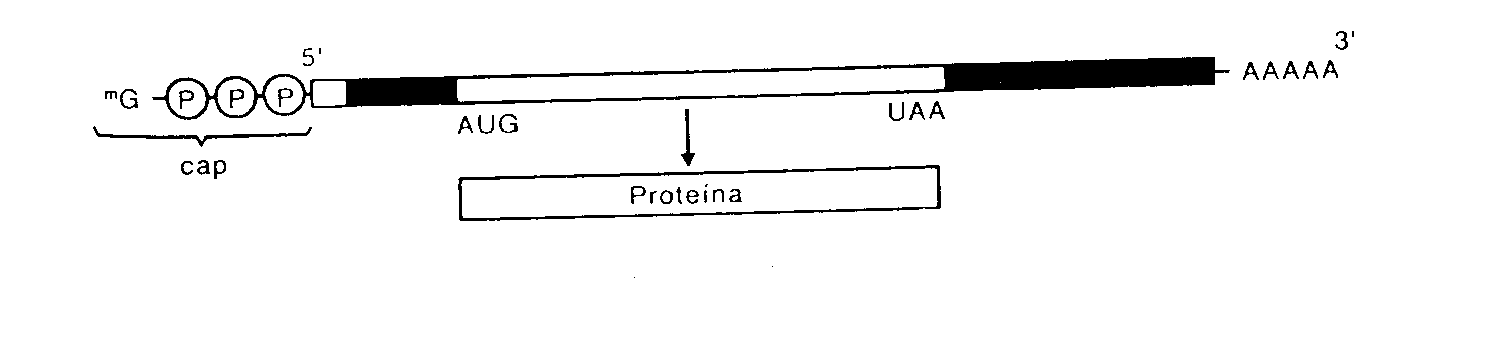
Cualquiera que sea su longitud, la proteína mantiene el carácter anfotérico de los aminoácidos aislados, ya que contiene un grupo amino libre en uno de sus extremos y un grupo carboxilo en el otro extremo. La proteína se sintetiza a partir de extremo que lleva el grupo amino libre. Ello se corresponde con la dirección 5´ ® 3´ usada para la traducción del ARNm, la misma con que el ADN se transcribe
Antes de describir los procesos que dan lugar a la síntesis de las proteínas analizaremos cómo arriban los ARNm al citoplasma, qué configuración poseen los ARNt y cuál es la estructura de los ribosomas.
Los ARNm salen hacia el citoplasma por los poros de la envoltura nuclear. Ya en el citosol, cada ARNm se combina con nuevas proteínas y con ribosomas, lo que lo habilita para ejercer su función codificadora durante la síntesis proteica. Entre las proteínas se encuentra la llamada CBP (por cap binding protein), que se combina con el cap en el extremo 5´ del ARNm. Su papel será analizado más adelante.
Algunos ARNm se localizan en sitios prefijados en el citoplasma, de modo que las proteínas que codifican se sintetizan y se concentran en esos sitios. Un ejemplo es el ARNm de la actina, que se sitúa en la zona periférica de las células epiteliales donde se deposita la mayor parte de la actina .
El extremo 5' de los ARNm contiene una secuencia de alrededor de 10 nucleótidos previa al codón de iniciación -entre éste y el cap - que, como es lógico, no se traduce (fig. A-2). En algunos ARNm esta secuencia participa en el control de 1a traducción y en otros regula la estabilidad del ARNm, es decir, su supervivencia.
Otra secuencia especial del ARNm, de hasta miles de nucleótidos, suele hallarse después del codón de terminación. entre éste y la poli A . Tiene por función controlar la supervivencia del ARNm.
Así la función básica de los ARNt es alinear a los aminoácidos siguiendo el orden de los codones para poder cumplir con sus funciones, los ARNt ,adquieren una forma característica semejante a un trébol de cuatro hojas (fig. A-3). Los cuatro brazos se generan por la presencia en los ARNt de secuencias de 3 a 5 pares de nuelcótidos complementarios, los cuales se aparean entre sí como los nucleótidos de las dos cadenas del ADN.
En la punta de uno de los brazos confluyen los extremos 5' y 3´ del ARNt. El extremo 3´ es más largo, de modo que sobresale el trinucleótido CCA que fue incorporado durante el procesamiento. Este brazo se llama aceptador porque a él se liga el aminoácido, que se une a la A del CCA.
Los tres brazos restantes poseen en sus extremos secuencias de 7 a 8 nucleótidos no apareados, -con
forma de asas -, cuyas denominaciones derivan de los nucleótidos que las caracterizan. Una de ellas contiene el triplete de nueleótidos del anticodón, por lo que su composición varía en cada tipo de ARNt. Otra, en virtud de que contiene dihidrouridinas (D), se denomina asa D. La tercera se conoce como asa T, por el trinucleótido Ty C que la identifica. La letra T simboliza a la ribotimidina y la y a la seudouri dina.
Entre el asa T y el anticodón existe un asa adicional, llamada variable porque su longitud difiere en los distintos ARN de transferencia.
Un plegamiento ulterior en el ARNt hace que deje de parecerse a un trébol de cuatro hojas y adquiera la forma de la letra L (fig. A-4). El cambio se debe a que se establecen apareamientos inusuales entre algunos nueleótidos, como la combinación de un nucleótido con dos a la vez.
Formada la L, las asas D y T pasan a la zona de unión de sus dos ramas y el brazo aceptador y el triplete de bases del anticodón se sitúan en las puntas de la molécula (fig. A-4).
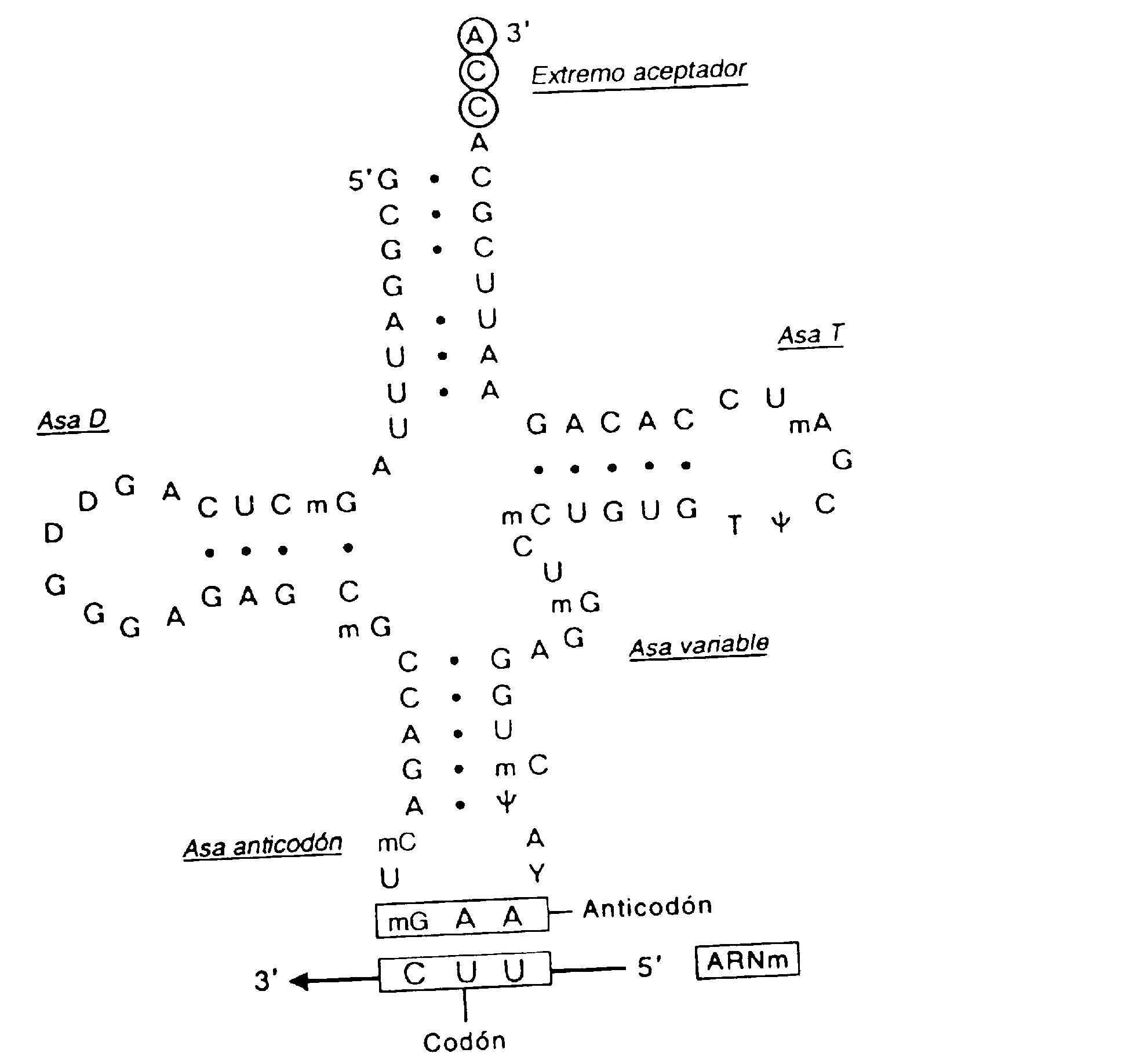 FIGURA A-3
FIGURA A-3
 FIGURA A-4
FIGURA A-4
Durante el primero, el aminoácido se liga a un AMP , con el cual forma un aminoacil AMP. Por ejemplo leucinil –AMP , lisinil AMP, fenilalanil AMP, metionil-AMP, etc.. Dado que el AMP deriva de la hidrólisis de un ATP , se libera pirofosfato (PP) y energía , que también pasa al aminoacil- AMP
AA + ATP® AA-AMP + PP
En el segundo paso esa energía es utilizada por la aminoacil ARNt sintetasa para transferir el aminoácido del aminoacil –AMP a la A del brazo aceptador del ARNt compatible, con lo cual se forma una molécula esencial para la síntesis proteica: el aminoacil-ARNtAA que reconoce el codón complementario en el ARNm.
AA-A + ARNt ® ( AMINOACIL SINTETASA)® AA-ARNtAA + AMP
Debe señalarse que la energía del ATP usada en la primera reacción queda depositada en la unión química entre el aminoácido y la A del trinucleótido CCA.
se ligue sólo a uno de los 20 aminoácidos usados en la síntesis proteica. Ello es posible porque cada aminoacil ARNt sintetasa identifica al ARNt por el anticodón, la parte más específica del ARNt (Fig A-3). No obstante, en los ARNt existen otras señales que son reconocidas por la enzima, generalmente tramos de nucleótidos cercanos al anticodón.
Como es obvio, la existencia de 11 clases de ARNt hace que algunos aminoácidos sean reconocidos por más de un ARNt.
Uno de los ARNt redundantes es el llamado ARNt iniciador o ARNt[i], pues transporta a la metionina destinada exclusivamente al codón AUG de iniciación (FIG A-9). Es muy probable quecerca de ese codón existan señales que diferencien al metionil-ARNt[i]met –portador de la metionina dirigida a él- de los metionil ARNtmet comunes, portadores de las metioninas destinadas a los restantes codones AUG del ARNm.
Luego el ribosoma se desliza hacia el extremo 3´del ARNm y traduce a los sucesivos tripletes en aminoácidos. Estos son traídos – de a uno por vez – por los respectivos ARNt. Las reacciones que ligan a los aminoácidos entre sí - es decir , las uniones peptídicas - se producen dentro del ribosoma . Finalmente, cuando el ribosoma arriba al codón de terminación – en el extremo 3´del ARNm – cesa la síntesis proteica y se libera la proteína. Como podemos notar, los ribosomas constituyen las "fábricas de las proteínas"
Cada ribosoma está compuesto por dos subunidades - una mayor y otra menor – identificadas con las siglas 40S y 60S respectivamente (los números hacen referencia a los coeficientes de sedimentación de las subunidades, es decir a las velocidades con que sedimentan cuando son ultracentrifugadas, la 60S migra más rápido al fondo del tubo).
En la subunidad menor algunas proteínas forman dos áreas - una al lado de la otra – denominadas sitio P (por peptidil) y sitio A (por aminoacil).
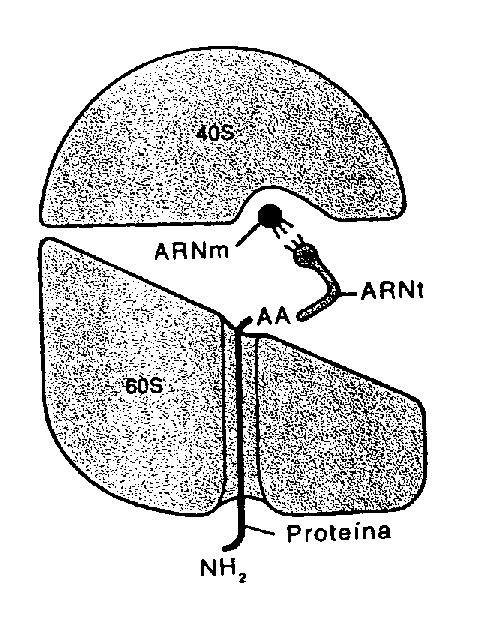 Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetiza
Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetiza
Las etapas de la síntesis de proteínas
La síntesis de las proteínas se divide en tres etapas, llamadas de iniciación , de alargamiento y de terminación (fig. A-9).
El primer proceso involucra al cap y a una secuencia de nucleótidos aledaña, localizada entre el cap y el codón de iniciación . Estas partes reconocidas por el factor IF-4, que se liga a ellas sí al ARNm se proteína CBP . La conexión del IF-4 con el ARNm insume energía que es provista por un ATP.
En el segundo proceso, el metioníl-ARNt[i]met se coloca en el sitio P de la subunidad menor del ribosoma, reacción que requiere el factor IF-2 y la energía de un GTP.
Logrados ambos acondicionamientos, otro factor de iniciación, el IF-3, con la ayuda del IF-4 coloca el extremo 5´ del ARNm sobre una de las caras de la unidad menor del ribosoma, la que posee los sitios P y A.
De inmediato la subunidad menor se desliza por el ARNm y detecta al codón de AUG de iniciación, que se coloca, en el sitio P . Como es lógico , el segundo codón del ARNm queda colocado al lado, es decir en el sitio A.
Entre tanto, el metioril-ARNt[i]met ,' ubicado en el sitio P de la subunidad menor, se une al codón AUG de iniciación mediante su anticodón CAU (UAC¬ ). El acoplamiento correcto entre estos dos tripletes es imprescindible para asegurar el encuadre normal de los siguientes codones del ARNm en los sitios P y A del ribosoma.
La etapa de iniciación concluye cuando la subunidad menor se combina con la subunidad mayor y se forma el ribosoma. En él se encuentran los primeros dos codones del ARNm: en el sitio P el codón AUG de iniciación -unido al metionilARNt[i]met- y en el sitio A el codón que le sigue.
La unión entre sí de las dos subunidades ribosómicas se produce luego del desprendimiento del IF-2 y del IF-3, lo cual es mediado por el factor IF-5.
Al quedar el aminoacil-ARNtAA cerca del metionil-ARN[t]met. la metionina localizada en el sitio P, al tiempo que se desacopla del. ARNt[i], se liga - mediante una unión peptidica - al aminoácido ubicado en el sitio A. Se forma así un dipeptidil-ARNt, que continúa ubicado en el sitio A. Su permanencia en este sitio es breve, en seguida veremos por qué.
La unión peptídica es catalizada por la subunidad mayor del ribosoma. Debe agregarse que la energía requerida para consumar esa unión proviene de la ruptura de otra unión química , aquella que liga al aminoácido con la adenina en el brazo aceptador del ARNt. Como en el caso del metionil – ARNt [i]met, la ruptura química tiene lugar siempre en el sitio P.
Entre tanto, fuera del ribosoma, esperando para ingresar, se encuentra el tercer codón del ARNm. Aborda el ribosoma cuando el ARNm se corre tres nucleótidos en dirección de su extremo 5´. Este proceso – llamado traslocación – es mediado por el el factor de elongación EF-2 y también consume energía ahora aportada por un GTP.
Como vemos, desde el punto de vista energético la síntesis proteica es bastante costosa, ya que por cada aminoácido que se incorpora se consumen dos GTP y un ATP, el último gastado durante 1a síntesis del aminoacil-ARNtAA
El corrimiento del ARNm hace que el codón de iniciación sea desalojado del sitio P sitio P -y, por consiguiente, del ribosoma- el segundo codón se mude del sitio A al sitio P y el tercer codón ingrese en el sitio A vacante. Lógicamente el corrimiento de los codones desplaza también a los ARNt , por lo que el ARNt[i] sale del ribosoma -no tarda en desprenderse del codón de iniciación – y el dipéptido pasa del sitio A al sitio P.
Mientras tanto, un tercer aminoacil-ARNtAA ingresa en le ribosoma , se acomoda en el sitio A y su anticodón se une al tercer codón de ARNm, otra vez por la intervención del EF-1. Debe señalarse que el EF-1 actúa después que el EF-2 se retira del ribosoma, y viceversa.
El paso siguiente comprende la formación de una unión peptídica entre el dipéptido y el aminoácido del tercer aminoacil –ARNt AA. Esta unión peptídica, ahora entre e dipéptido y el aminoácido del tercer aminoacil-ARNtAA. Esta unión peptídica genera un tripeptidil –AARNt, que permanece en el sitio P hasta la próxima translocación del ARNm.
Los procesos citados se repiten de forma sucesiva codón tras codón ; así , en el cuarto paso se forma un tetrapeptidil ARNt y luego peptidil - ARNt cada vez más largos , que se traslocan del sitio A al P conforme se producen las uniones peptídicas. Se calcula que se agregan a la cadena, en promedio, cinco aminoácidos por segundo.
Debido a que con cada traslocación se corren tres nucleótidos del ARNm , su extremo 5´se aleja progresivamente del ribosoma y su extremo 3´se acerca a él en igual medida. Cuando el ribosoma se ha alejado del extremo 5´del ARNm unos 90 nucleótidos, en el codón de iniciación se acomoda un nuevo ribosoma, lo cual da inicio a la síntesis de otra cadena proteica. Esto se repite varias veces .
En síntesis la terminación de la cadena polipeptídica está señalada por el ARNm mediante un codón que no especifica la incorporación de ningún aminoácido . Ese codón de terminación puede ser UUA, UGA o UAG, y sobre él no se une ningún ARNt. En cambio, es reconocido por dos proteínas llamadas factores de liberación (eRF). Cuando esto sucede, la proteína terminada se libera del último ARNt, que también se separa del ARNm. Por último también se disocian las subunidades ribosómicas. Todos estos elementos pueden ser reutilizados en una nueva síntesis.
b) Alargamiento. Un segundo ARNt con su aminoácido unido se mueve al sitio A y su anticodón se enchufa en el mRNA. Se forma un enlace peptidico entre los dos aminoácidos reunidos en el ribosoma. Al mismo tiempo, se rompe el enlace entre el primer aminoácido y su ARNt. El ribosoma se mueve a lo largo de la cadena de ARNm en una dirección 5´ a 3´ y el segundo ARNt, con el dipéptido unido se mueve al sitio P desde el sitio A, a medida que el primer ARNt se desprende del ribosoma. Un tercer ARNt se mueve al sitio A y se forma otro enlace peptÍdico. La cadena peptídica naciente siempre está unida al tRNA que se está moviendo del sitio A al sitio P, y el ARNt entrante que lleva el siguiente aminoácido siempre ocupa el sitio A. Este paso se repite una y otra vez hasta que se completa el polipéptido. c) Terminación. Cuando el ribosoma alcanza un codón de terminación (en este ejemplo UGA), el polipéptido se escinde del último ARNt y el ARNt se desprende del sitio P. El sitio A es ocupado por el factor de liberación que produce la disociación de las dos subunidades del ribosoma
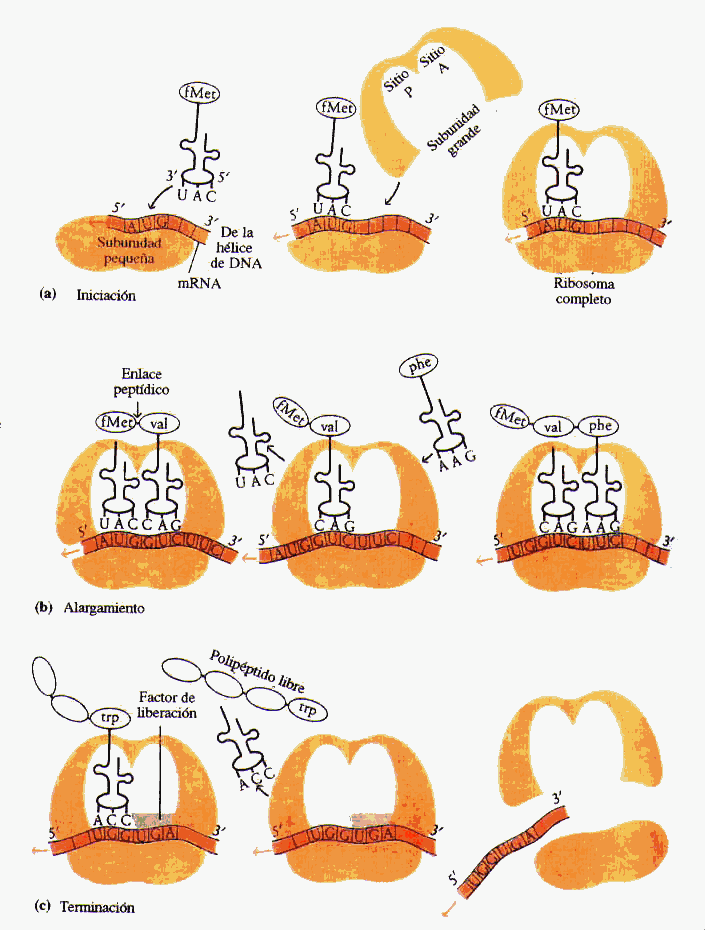 .
.
Al ser invadidas por bacterias, las células de algunos organismos inferiores elaboran sustancias llamadas antibióticos para defenderse de la infección. En muchos casos los antibióticos logran sus objetivos interfiriendo la síntesis proteica en los ribosomas de las bacterias, lo que las mata. Por ejemplo, el cloranfenicol impide las uniones peptídicas, la estreptomicina afecta el inicio de la traducción y distorsiona la fidelidad de la síntesis, la eritromicina bloquea la translocación del ARNm, la tetraciclina no permite que los aminoacil-ARNtAA ingresen en el sitio A, la kirromiicina inhibe la actividad de los factores de elongación y la puromicina usurpa el sitio A del ribosoma, de modo que la cadena peptídica se liga al antibiótico y no a un aminoacil-ARNtAA, lo que interrumpe su síntesis.
La medicina ha trasladado estos efectos a otros escenarios biológicos, particularmente al organismo humano. Así, cuando determinadas bacterias lo infectan, éstas pueden ser destruidas mediante la administración de antibióticos.
Debe advertirse que la puromicina afecta también a los ribosomas de las células eucariotas, y por ello su uso farmacológico es muy restringido. Por su parte, el cloranfenicol, la eritromicina, la tetraciclina y la kirromicina, si bien interfieren levemente la síntesis proteica en los ribosomas eucarióticos citosólicos, afectan mucho más la de los ribosomas de las mitocondrias , lo cual reafirma la teoría endosimbiótica.
Otro tema médico vinculado con los ribosomas corresponde al mecanismo de acción de la toxina diftérica , que ingresa en la célula por endocitosis y ribosila al factor de elongación EF-2 , lo cual lo anula. Ello conduce en poco tiempo a la muerte.
Click aquí, para ver y descargar el archivo.
INTRODUCCION
El ARN mensajero es el que lleva la información para la síntesis de proteínas, es decir, determina el orden en que se unirán los aminoácidos
La síntesis de proteínas o traducción tiene lugar en los ribosomas del citoplasma celular. Los aminoácidos son transportados por el ARN de transferencia (ARNt) , específico para cada uno de ellos, y son llevados hasta el ARN mensajero (ARNm), dónde se aparean el codón de éste y el anticodón del ARN de transferencia, por complementariedad de bases, y de ésta forma se sitúan en la posición que les corresponde.
Una vez finalizada la síntesis de una proteína, el ARN mensajero queda libre y puede ser leído de nuevo. De hecho, es muy frecuente que antes de que finalice una proteínaya está comenzando otra, con lo cual, una misma molécula de ARN mensajero, está siendo utilizada por varios ribosomassimultáneamente.
- Los ARNt desempeñan un papel central en la síntesis de las proteínas
La síntesis de las proteínas comienza con la unión entre sí de dos aminoácidos y continúa por el agregado de nuevos aminoácidos -de a uno por vez- en uno extremos de la cadena.
Como se sabe la clave de la traducción reside en el código genético, compuesto por combinaciones de tres nucleótidos consecutivos -o tripletes- en el ARNm. Los distintos tripletes se relacionan específicamente con tipos de aminoácidos usados en la síntesis de las proteínas.
Cada triplete constituye un codón: existen en total 64 codones, 61 de los cuales sirven para cifrar aminoácidos y 3 para marcar el cese de la traducción. Tal cantidad deriva de una relación matemática simple: los cuatro nucleótidos (A, U, C y G)se combinan de a tres, por lo que pueden generarse 64 (43).
Dado que existen más codones, (61) que tipos de aminoácidos (20), casi todos pueden ser reconocidos por más de un codón, por lo que algunos tripletes a como "sinónimos". Solamente el triptófano y la metionina -dos de los aminoácidos menos frecuentes en las proteínas - son codificados, cada uno, por un solo codón
Fig. A-1. Los dibujos ilustran cuatro de los seis codones que codifican al aminoácido leucina (Leu). Los dos de la izquierda se aparean con un mismo anticodón, igual que el par de codones de la derecha. Ello es posible porque la tercera base de los codones suele ser "adaptable ", es decir, puede establecer uniones con una base no complementaria.

Generalmente los codones que representan a un mismo aminoácido se parecen entre sí y es frecuente que difieran sólo en el tercer nucleótido. La baja especificidad de este nucleótido ha llevado a decir que existe una "degeneración" en tercera base de la mayoría de los codones. Resta agregar que el número de codones en el ARNm determina la longitud de la proteína.
- Existen 31 tipos diferentes de ARNt
Cada tipo de ARNt lleva antepuesto el nombre del aminoácido que transporta. por ejemplo, leucinil-ARNt para el aminoacil-ARNt de la leucina, lisinil-ARNt para el de la lisina, fenilalanil-ARNt para el de la fenilalanina, metionil-ARNt para el de la metionina, etcétera.
Por su lado. El ARNt unido al aminoácido compatible con él se designa aminoacil-ARNtAA, en el que "AA" correspnde a la sigla del aminoácido. Por ejemplo, leucinil-ARNtLeu, lisinil-ARNtlys, fenilalanil-ARNtPhe. metionil-ARNtMet, etcétera.
Si bien teóricamente pueden existir 61 tipos de ARNt diferentes, sólo hay 31. El déficit se resuelve por la capacidad que tienen algunos ARNt de reconocer a más de un codón. Lo logran porque sus anticodones suelen poseer la primera base "adaptable", es decir, que puede unirse con una base no complementaria situada en la tercera posición del codón (recuérdese la "degeneración" de esta base).
Así, la G en la primera posición del anticodón puede aparearse tanto con una C -es lo habitual - como con una U del codón (fig. A-1). Similarmente, la U en la primera posición del anticodón puede hacerlo con una A -es lo habitual - o con una G. Por otra parte, la inosina (I) -una de las bases inusuales se encuentra en la primera posición del anticodón en varios ARNt y es capaz de aparearse con cualquier base (excepto con una G) localizada en la tercera posición del codón.
- El codón de iniciación es el triplete AUG
Al especificar el primer aminoácido de la proteína, el codón AUG de iniciación determina el encuadre de los sucesivos tripletes, lo que asegura la síntesis correcta de la molécula. Tómese como ejemplo la secuencia AUGGCCUGUAACGGU. Si el ARNm es traducido a partir del codón AUG, los codones
siguientes serán GCC, UGU, AAC y GGU, que codifican, respectivamente, a los aminoácidos alanina, cisteina ,asparagina y glicina. En cambio, si se omitiera la A del codón de iniciación, el encuadre de los tripletes sería el siguiente: UGG, CCU, GUA y ACG, los cuales se traducen en los aminoácidos triptófano, prolina, valina y treonina, respectivamente.
Algo semejante ocurriría si también se omitiera la U, pues resultaría un tercer tipo de encuadre: GGC, CUG, UAA y CGC. En este caso, después de codificar los dos primeros codones a los aminoácidos glicina y leucina, la traducción se detendría, ya que UAA es un codón de terminación.
Fig. A-2

- Los aminoácidos se ligan por medio de uniones peptídicas
Cualquiera que sea su longitud, la proteína mantiene el carácter anfotérico de los aminoácidos aislados, ya que contiene un grupo amino libre en uno de sus extremos y un grupo carboxilo en el otro extremo. La proteína se sintetiza a partir de extremo que lleva el grupo amino libre. Ello se corresponde con la dirección 5´ ® 3´ usada para la traducción del ARNm, la misma con que el ADN se transcribe
Antes de describir los procesos que dan lugar a la síntesis de las proteínas analizaremos cómo arriban los ARNm al citoplasma, qué configuración poseen los ARNt y cuál es la estructura de los ribosomas.
- Los ARNm arribados al citoplasma se conectan con ríbosomas
Los ARNm salen hacia el citoplasma por los poros de la envoltura nuclear. Ya en el citosol, cada ARNm se combina con nuevas proteínas y con ribosomas, lo que lo habilita para ejercer su función codificadora durante la síntesis proteica. Entre las proteínas se encuentra la llamada CBP (por cap binding protein), que se combina con el cap en el extremo 5´ del ARNm. Su papel será analizado más adelante.
Algunos ARNm se localizan en sitios prefijados en el citoplasma, de modo que las proteínas que codifican se sintetizan y se concentran en esos sitios. Un ejemplo es el ARNm de la actina, que se sitúa en la zona periférica de las células epiteliales donde se deposita la mayor parte de la actina .
El extremo 5' de los ARNm contiene una secuencia de alrededor de 10 nucleótidos previa al codón de iniciación -entre éste y el cap - que, como es lógico, no se traduce (fig. A-2). En algunos ARNm esta secuencia participa en el control de 1a traducción y en otros regula la estabilidad del ARNm, es decir, su supervivencia.
Otra secuencia especial del ARNm, de hasta miles de nucleótidos, suele hallarse después del codón de terminación. entre éste y la poli A . Tiene por función controlar la supervivencia del ARNm.
- Las moléculas de los ARNt adquieren una forma característica
Así la función básica de los ARNt es alinear a los aminoácidos siguiendo el orden de los codones para poder cumplir con sus funciones, los ARNt ,adquieren una forma característica semejante a un trébol de cuatro hojas (fig. A-3). Los cuatro brazos se generan por la presencia en los ARNt de secuencias de 3 a 5 pares de nuelcótidos complementarios, los cuales se aparean entre sí como los nucleótidos de las dos cadenas del ADN.
En la punta de uno de los brazos confluyen los extremos 5' y 3´ del ARNt. El extremo 3´ es más largo, de modo que sobresale el trinucleótido CCA que fue incorporado durante el procesamiento. Este brazo se llama aceptador porque a él se liga el aminoácido, que se une a la A del CCA.
Los tres brazos restantes poseen en sus extremos secuencias de 7 a 8 nucleótidos no apareados, -con
forma de asas -, cuyas denominaciones derivan de los nucleótidos que las caracterizan. Una de ellas contiene el triplete de nueleótidos del anticodón, por lo que su composición varía en cada tipo de ARNt. Otra, en virtud de que contiene dihidrouridinas (D), se denomina asa D. La tercera se conoce como asa T, por el trinucleótido Ty C que la identifica. La letra T simboliza a la ribotimidina y la y a la seudouri dina.
Entre el asa T y el anticodón existe un asa adicional, llamada variable porque su longitud difiere en los distintos ARN de transferencia.
Un plegamiento ulterior en el ARNt hace que deje de parecerse a un trébol de cuatro hojas y adquiera la forma de la letra L (fig. A-4). El cambio se debe a que se establecen apareamientos inusuales entre algunos nueleótidos, como la combinación de un nucleótido con dos a la vez.
Formada la L, las asas D y T pasan a la zona de unión de sus dos ramas y el brazo aceptador y el triplete de bases del anticodón se sitúan en las puntas de la molécula (fig. A-4).
 FIGURA A-3
FIGURA A-3 FIGURA A-4
FIGURA A-4- Una aminoacil-ARNt sintetasa une el aminoácido al ARNt
Durante el primero, el aminoácido se liga a un AMP , con el cual forma un aminoacil AMP. Por ejemplo leucinil –AMP , lisinil AMP, fenilalanil AMP, metionil-AMP, etc.. Dado que el AMP deriva de la hidrólisis de un ATP , se libera pirofosfato (PP) y energía , que también pasa al aminoacil- AMP
AA + ATP® AA-AMP + PP
En el segundo paso esa energía es utilizada por la aminoacil ARNt sintetasa para transferir el aminoácido del aminoacil –AMP a la A del brazo aceptador del ARNt compatible, con lo cual se forma una molécula esencial para la síntesis proteica: el aminoacil-ARNtAA que reconoce el codón complementario en el ARNm.
AA-A + ARNt ® ( AMINOACIL SINTETASA)® AA-ARNtAA + AMP
Debe señalarse que la energía del ATP usada en la primera reacción queda depositada en la unión química entre el aminoácido y la A del trinucleótido CCA.
- Existen 20 amínoacil – ARNt sintetasas diferentes
se ligue sólo a uno de los 20 aminoácidos usados en la síntesis proteica. Ello es posible porque cada aminoacil ARNt sintetasa identifica al ARNt por el anticodón, la parte más específica del ARNt (Fig A-3). No obstante, en los ARNt existen otras señales que son reconocidas por la enzima, generalmente tramos de nucleótidos cercanos al anticodón.
Como es obvio, la existencia de 11 clases de ARNt hace que algunos aminoácidos sean reconocidos por más de un ARNt.
Uno de los ARNt redundantes es el llamado ARNt iniciador o ARNt[i], pues transporta a la metionina destinada exclusivamente al codón AUG de iniciación (FIG A-9). Es muy probable quecerca de ese codón existan señales que diferencien al metionil-ARNt[i]met –portador de la metionina dirigida a él- de los metionil ARNtmet comunes, portadores de las metioninas destinadas a los restantes codones AUG del ARNm.
- Los ribosomas están compuestos por dos subunidades
Luego el ribosoma se desliza hacia el extremo 3´del ARNm y traduce a los sucesivos tripletes en aminoácidos. Estos son traídos – de a uno por vez – por los respectivos ARNt. Las reacciones que ligan a los aminoácidos entre sí - es decir , las uniones peptídicas - se producen dentro del ribosoma . Finalmente, cuando el ribosoma arriba al codón de terminación – en el extremo 3´del ARNm – cesa la síntesis proteica y se libera la proteína. Como podemos notar, los ribosomas constituyen las "fábricas de las proteínas"
Cada ribosoma está compuesto por dos subunidades - una mayor y otra menor – identificadas con las siglas 40S y 60S respectivamente (los números hacen referencia a los coeficientes de sedimentación de las subunidades, es decir a las velocidades con que sedimentan cuando son ultracentrifugadas, la 60S migra más rápido al fondo del tubo).
En la subunidad menor algunas proteínas forman dos áreas - una al lado de la otra – denominadas sitio P (por peptidil) y sitio A (por aminoacil).
 Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetiza
Por
otro lado en la subunidad mayor las proteínas
ribosómicas formarían un
túnel por el que saldría la cadena
polipeptídica a medida que se sintetizaLas etapas de la síntesis de proteínas
La síntesis de las proteínas se divide en tres etapas, llamadas de iniciación , de alargamiento y de terminación (fig. A-9).
- El comienzo de la síntesis proteica requiere de varios factores de iniciación
El primer proceso involucra al cap y a una secuencia de nucleótidos aledaña, localizada entre el cap y el codón de iniciación . Estas partes reconocidas por el factor IF-4, que se liga a ellas sí al ARNm se proteína CBP . La conexión del IF-4 con el ARNm insume energía que es provista por un ATP.
En el segundo proceso, el metioníl-ARNt[i]met se coloca en el sitio P de la subunidad menor del ribosoma, reacción que requiere el factor IF-2 y la energía de un GTP.
Logrados ambos acondicionamientos, otro factor de iniciación, el IF-3, con la ayuda del IF-4 coloca el extremo 5´ del ARNm sobre una de las caras de la unidad menor del ribosoma, la que posee los sitios P y A.
De inmediato la subunidad menor se desliza por el ARNm y detecta al codón de AUG de iniciación, que se coloca, en el sitio P . Como es lógico , el segundo codón del ARNm queda colocado al lado, es decir en el sitio A.
Entre tanto, el metioril-ARNt[i]met ,' ubicado en el sitio P de la subunidad menor, se une al codón AUG de iniciación mediante su anticodón CAU (UAC¬ ). El acoplamiento correcto entre estos dos tripletes es imprescindible para asegurar el encuadre normal de los siguientes codones del ARNm en los sitios P y A del ribosoma.
La etapa de iniciación concluye cuando la subunidad menor se combina con la subunidad mayor y se forma el ribosoma. En él se encuentran los primeros dos codones del ARNm: en el sitio P el codón AUG de iniciación -unido al metionilARNt[i]met- y en el sitio A el codón que le sigue.
La unión entre sí de las dos subunidades ribosómicas se produce luego del desprendimiento del IF-2 y del IF-3, lo cual es mediado por el factor IF-5.
- El alargamiento de la cadena proteica es promovido por factores de elongación
Al quedar el aminoacil-ARNtAA cerca del metionil-ARN[t]met. la metionina localizada en el sitio P, al tiempo que se desacopla del. ARNt[i], se liga - mediante una unión peptidica - al aminoácido ubicado en el sitio A. Se forma así un dipeptidil-ARNt, que continúa ubicado en el sitio A. Su permanencia en este sitio es breve, en seguida veremos por qué.
La unión peptídica es catalizada por la subunidad mayor del ribosoma. Debe agregarse que la energía requerida para consumar esa unión proviene de la ruptura de otra unión química , aquella que liga al aminoácido con la adenina en el brazo aceptador del ARNt. Como en el caso del metionil – ARNt [i]met, la ruptura química tiene lugar siempre en el sitio P.
Entre tanto, fuera del ribosoma, esperando para ingresar, se encuentra el tercer codón del ARNm. Aborda el ribosoma cuando el ARNm se corre tres nucleótidos en dirección de su extremo 5´. Este proceso – llamado traslocación – es mediado por el el factor de elongación EF-2 y también consume energía ahora aportada por un GTP.
Como vemos, desde el punto de vista energético la síntesis proteica es bastante costosa, ya que por cada aminoácido que se incorpora se consumen dos GTP y un ATP, el último gastado durante 1a síntesis del aminoacil-ARNtAA
El corrimiento del ARNm hace que el codón de iniciación sea desalojado del sitio P sitio P -y, por consiguiente, del ribosoma- el segundo codón se mude del sitio A al sitio P y el tercer codón ingrese en el sitio A vacante. Lógicamente el corrimiento de los codones desplaza también a los ARNt , por lo que el ARNt[i] sale del ribosoma -no tarda en desprenderse del codón de iniciación – y el dipéptido pasa del sitio A al sitio P.
Mientras tanto, un tercer aminoacil-ARNtAA ingresa en le ribosoma , se acomoda en el sitio A y su anticodón se une al tercer codón de ARNm, otra vez por la intervención del EF-1. Debe señalarse que el EF-1 actúa después que el EF-2 se retira del ribosoma, y viceversa.
El paso siguiente comprende la formación de una unión peptídica entre el dipéptido y el aminoácido del tercer aminoacil –ARNt AA. Esta unión peptídica, ahora entre e dipéptido y el aminoácido del tercer aminoacil-ARNtAA. Esta unión peptídica genera un tripeptidil –AARNt, que permanece en el sitio P hasta la próxima translocación del ARNm.
Los procesos citados se repiten de forma sucesiva codón tras codón ; así , en el cuarto paso se forma un tetrapeptidil ARNt y luego peptidil - ARNt cada vez más largos , que se traslocan del sitio A al P conforme se producen las uniones peptídicas. Se calcula que se agregan a la cadena, en promedio, cinco aminoácidos por segundo.
Debido a que con cada traslocación se corren tres nucleótidos del ARNm , su extremo 5´se aleja progresivamente del ribosoma y su extremo 3´se acerca a él en igual medida. Cuando el ribosoma se ha alejado del extremo 5´del ARNm unos 90 nucleótidos, en el codón de iniciación se acomoda un nuevo ribosoma, lo cual da inicio a la síntesis de otra cadena proteica. Esto se repite varias veces .
- La síntesis proteica concluye cuando el ribosoma alcanza el codón de terminación
En síntesis la terminación de la cadena polipeptídica está señalada por el ARNm mediante un codón que no especifica la incorporación de ningún aminoácido . Ese codón de terminación puede ser UUA, UGA o UAG, y sobre él no se une ningún ARNt. En cambio, es reconocido por dos proteínas llamadas factores de liberación (eRF). Cuando esto sucede, la proteína terminada se libera del último ARNt, que también se separa del ARNm. Por último también se disocian las subunidades ribosómicas. Todos estos elementos pueden ser reutilizados en una nueva síntesis.
RESUMEN
Tres etapas en la síntesis de
proteínas. a) Iniciación. La subunidad
ribosómica más pequeña se une al extremo
5´ de una molécula de ARNm. La primera
molécula de ARNt, que lleva el aminoácido
modificado fMet, se enchufa en el codón iniciador AUG de
la molécula deARNm. La unidad ribosómica más
grande se ubica en su lugar, el ARNt ocupa el sitio P
(peptidico). El sitio A (aminoacil) está vacante. El
complejo de iniciación está completo
ahora.b) Alargamiento. Un segundo ARNt con su aminoácido unido se mueve al sitio A y su anticodón se enchufa en el mRNA. Se forma un enlace peptidico entre los dos aminoácidos reunidos en el ribosoma. Al mismo tiempo, se rompe el enlace entre el primer aminoácido y su ARNt. El ribosoma se mueve a lo largo de la cadena de ARNm en una dirección 5´ a 3´ y el segundo ARNt, con el dipéptido unido se mueve al sitio P desde el sitio A, a medida que el primer ARNt se desprende del ribosoma. Un tercer ARNt se mueve al sitio A y se forma otro enlace peptÍdico. La cadena peptídica naciente siempre está unida al tRNA que se está moviendo del sitio A al sitio P, y el ARNt entrante que lleva el siguiente aminoácido siempre ocupa el sitio A. Este paso se repite una y otra vez hasta que se completa el polipéptido. c) Terminación. Cuando el ribosoma alcanza un codón de terminación (en este ejemplo UGA), el polipéptido se escinde del último ARNt y el ARNt se desprende del sitio P. El sitio A es ocupado por el factor de liberación que produce la disociación de las dos subunidades del ribosoma
 .
.
APLICACIONES
Dos temas médicos vinculados con la
actividad de los ribosomasAl ser invadidas por bacterias, las células de algunos organismos inferiores elaboran sustancias llamadas antibióticos para defenderse de la infección. En muchos casos los antibióticos logran sus objetivos interfiriendo la síntesis proteica en los ribosomas de las bacterias, lo que las mata. Por ejemplo, el cloranfenicol impide las uniones peptídicas, la estreptomicina afecta el inicio de la traducción y distorsiona la fidelidad de la síntesis, la eritromicina bloquea la translocación del ARNm, la tetraciclina no permite que los aminoacil-ARNtAA ingresen en el sitio A, la kirromiicina inhibe la actividad de los factores de elongación y la puromicina usurpa el sitio A del ribosoma, de modo que la cadena peptídica se liga al antibiótico y no a un aminoacil-ARNtAA, lo que interrumpe su síntesis.
La medicina ha trasladado estos efectos a otros escenarios biológicos, particularmente al organismo humano. Así, cuando determinadas bacterias lo infectan, éstas pueden ser destruidas mediante la administración de antibióticos.
Debe advertirse que la puromicina afecta también a los ribosomas de las células eucariotas, y por ello su uso farmacológico es muy restringido. Por su parte, el cloranfenicol, la eritromicina, la tetraciclina y la kirromicina, si bien interfieren levemente la síntesis proteica en los ribosomas eucarióticos citosólicos, afectan mucho más la de los ribosomas de las mitocondrias , lo cual reafirma la teoría endosimbiótica.
Otro tema médico vinculado con los ribosomas corresponde al mecanismo de acción de la toxina diftérica , que ingresa en la célula por endocitosis y ribosila al factor de elongación EF-2 , lo cual lo anula. Ello conduce en poco tiempo a la muerte.
sábado, 1 de septiembre de 2012
Transporte a travez de membrana y mapa Conseptual.
El siguiente es un mapa conceptual de los diferentes tipos de transporte a travez de la membrana célular.
Mapa Conseptual sobre los diferentes tipos de transporte a travez de la membrana.
Como se mencionó anteriormente, la difusión pasiva es un fenómeno espontáneo puesto que suceden incrementando la entropía del sistema, y disminuyendo la energía libre.
No requiere de la intervención de proteínas de membrana, pero sí de las
características de la sustancia a transportar y de la naturaleza de la
bicapa. Para el caso de una membrana fosfolipídica pura, la velocidad de
difusión de una sustancia depende de su:
Bajo el mismo principio termodinámico que en el caso de la difusión
simple, es decir, que el soluto a transportar lo hace a favor de
gradiente, la difusión facilitada opera de modo similar, pero está
facilitada por la existencia de proteínas canal,
que son las que facilitan el transporte de, en este caso, agua o
algunos iones y moléculas hidrófilas. Estas proteínas integrales de
membrana conforman estructuras en forma de poro inmersas en la bicapa,
que dejan un canal interno hidrofílico que permite el paso de moléculas
altamente lipófobas como las mencionadas anteriormente. La apertura de
este canal interno puede ser constitutiva, es decir, continua y
desregulada, en los canales no regulados, o bien puede requerir una señal que medie su apertura o cierre: es el caso de los canales regulados.
El descubrimiento de la existencia de este tipo de transportadores se produjo al estudiar cinéticamente la transferencia de moléculas a través de las membranas: para algunos solutos, se observó que la velocidad de entrada alcanza una meseta a partir de cierta concentración externa a partir de la cual no se produce un incremento significativo de velocidad de captación, esto es, surge una respuesta tipo curva logística. Se interpretó que el transporte aquí se produce por la formación de un complejo sustrato-transportador, conceptualmente idéntico al complejo enzima-sustrato de la cinética enzimática. Por ello, cada proteína transportadora posee una constante de afinidad por el soluto que es igual a la concentración del soluto cuando la velocidad de transporte es la mitad de su valor máximo (equivaldría, para el caso de un enzima, a la constante de Michaelis-Menten).
Algunos rasgos importantes del transporte activo, además de su capacidad de intervenir aun en contra de gradiente, su cinética y el empleo de ATP, son: su elevado grado de selectividad y su facilidad de inhibición farmacológica selectiva.
Una de las bombas de mayor relevancia en células animales es la bomba sodio-potasio, que opera mediante el mecanismo siguiente:
Para que un ion penetre en el poro, debe disociarse de las moléculas de agua que lo recubren en sucesivas capas de solvatación. La tendencia a deshidratarse, o la facilidad para hacerlo, está relacionada con el tamaño del ion: los iones grandes lo hacen con más facilidad que los pequeños, por lo que un poro con centros polares débiles admitirá preferentemente iones grandes, antes que pequeños.
Cuando el interior del canal está tapizado de grupos polares, procedentes de las cadenas laterales de sus aminoácidos componentes, la interacción del ion deshidratado con estos centros puede ser más importante que la facilidad de deshidratación para conferir la especificidad del canal. Por ejemplo, un canal revestido de histidinas y argininas, con grupos cargados positivamente, repelerá de forma selectiva a los iones cargados con el mismo signo, pero facilitará el paso de los cargados negativamente. Además, en este caso, los iones más pequeños pueden interactuar de forma más cercana por cuestiones estéricas, lo cual incrementa en mucho las interacciones carga-carga y, por tanto, exagera el efecto.
En el caso de que el no electrolito esté parcialmente cargado, es decir, sea más o menos polar, como es el caso del etanol, metanol o urea, se permite el paso a través de la membrana mediante canales acuosos inmersos en la membrana. Es interesante recalcar que no existe un mecanismo de regulación efectivo que establezca barreras a este transporte, lo que implica una vulnerabilidad intrínseca de las células a la penetración de estas moléculas.
Mapa Conseptual sobre los diferentes tipos de transporte a travez de la membrana.
Difusión simple
- gradiente de concentración,
- hidrofobicidad,
- tamaño,
- carga, si la molécula posee carga neta.
- a mayor gradiente de concentración, mayor velocidad de difusión,
- a mayor hidrofobicidad, esto es, mayor coeficiente de partición, mayor solubilidad en lípido y por tanto mayor velocidad de difusión,
- a mayor tamaño, menor velocidad de difusión,
- dado un potencial de membrana, es decir, la diferencia de potencial entre la cara exoplasmática y la endoplasmática de la membrana, y un gradiente de concentración se define un gradiente electroquímico que determina las direcciones de transporte energéticamente favorables de una molécula cargada, dependiendo de la naturaleza de ésta y del signo del potencial, si bien la mayor parte de las células animales poseen carga negativa en su exterior.
Difusión facilitada
Transporte activo y cotransporte
En él se efectúa un transporte en contra del gradiente de concentración o electroquímico y, para ello, las proteínas transportadoras implicadas consumen energía metabólica (comúnmente adenosín trifosfato). La hidrólisis del compuesto que actúa como moneda energética puede ser muy evidente, como en el caso de los transportadores que son ATPasas, o puede tener un origen indirecto: por ejemplo, los cotransportadores emplean gradientes de determinados solutos para impulsar el transporte de un determinado compuesto en contra de su gradiente, a costa de la disipación del primer gradiente mencionado. Pudiera parecer que en este caso no interviene un gasto energético, pero no es así puesto que el establecimiento del gradiente de la sustancia transportada colateralmente al compuesto objetivo ha requerido de la hidrólisis de ATP en su generación mediante unos determinados tipos de proteínas denominados bombas. Por ello, se define transporte activo primario como aquél que hidroliza ATP de forma directa para transportar el compuesto en cuestión, y transporte activo secundario como aquél que utiliza la energía almacenada en un gradiente electroquímico.El descubrimiento de la existencia de este tipo de transportadores se produjo al estudiar cinéticamente la transferencia de moléculas a través de las membranas: para algunos solutos, se observó que la velocidad de entrada alcanza una meseta a partir de cierta concentración externa a partir de la cual no se produce un incremento significativo de velocidad de captación, esto es, surge una respuesta tipo curva logística. Se interpretó que el transporte aquí se produce por la formación de un complejo sustrato-transportador, conceptualmente idéntico al complejo enzima-sustrato de la cinética enzimática. Por ello, cada proteína transportadora posee una constante de afinidad por el soluto que es igual a la concentración del soluto cuando la velocidad de transporte es la mitad de su valor máximo (equivaldría, para el caso de un enzima, a la constante de Michaelis-Menten).
Algunos rasgos importantes del transporte activo, además de su capacidad de intervenir aun en contra de gradiente, su cinética y el empleo de ATP, son: su elevado grado de selectividad y su facilidad de inhibición farmacológica selectiva.
Transportadores
Un transportador puede movilizar diversos iones y moléculas. Según la direccionalidad, se distinguen:- antiportadores: aquellos que transportan un tipo de molécula en contra de su gradiente al mismo tiempo que desplazan uno o más iones diferentes a favor del suyo, siendo ambos gradientes contrapuestos.
- simportadores: los que desplazan el compuesto a transportar en contra de su gradiente acoplando este trasiego al desplazamiento de uno o más iones diferentes a favor del suyo, que, en este caso, es equivalente al de la molécula a transportar.
Bombas
Una bomba es una proteína que hidroliza ATP para transportar a través de una membrana un determinado soluto a fin de generar un gradiente electroquímico que confiera unas características de potencial a ésta. Dicho gradiente posee un interés por sí mismo para la definición del estado de la célula, como es el potencial de Nernst, pero interviene activamente en el transporte de sustancias a través de la membrana, que es el tema aquí tratado, puesto que aporta un aumento de entropía al sistema en caso de cotransporte de sustancias que se encuentran en trasiego en contra de su gradiente.Una de las bombas de mayor relevancia en células animales es la bomba sodio-potasio, que opera mediante el mecanismo siguiente:
- Unión de tres Na+ a sus sitios activos.
- Fosforilación de la cara citoplasmática de la bomba que induce a un cambio de conformación en la proteína. Esta fosforilación se produce por la transferencia del grupo terminal del ATP a un residuo de ácido aspártico de la proteína.
- El cambio de conformación hace que el Na+ sea liberado al exterior.
- Una vez liberado el Na+, se unen dos moléculas de K+ a sus respectivos sitios de unión de la cara extracelular de la proteína.
- La proteína se desfosforila produciéndose un cambio conformacional de esta, lo que produce una transferencia de los iones de K+ al citosol.
Selectividad de membrana
Puesto que la característica primordial del transporte a través de una membrana biológica es la selectividad de ésta y su subsiguiente actuación como barrera específica para determinadas sustancias, la fisiología subyacente de este fenómeno ha sido estudiada profusamente. Clásicamente se ha dividido el estudio de esta propiedad en lo referente a electrolitos y a no electrolitos.Selectividad para electrolitos
Los canales iónicos definen un diámetro interno que permite el paso de pequeños iones de forma más o menos específica. Puesto que el tamaño del ion está relacionado con la especie química, se podría asumir a priori que un canal cuyo diámetro de poro fuera suficiente para el paso de un ion permitiría asimismo el trasiego de otros de menor tamaño, cosa que no sucede en la mayoría de los casos. Existen dos características ajenas al tamaño que son importantes en la determinación de la selectividad de los poros de la membrana: la facilidad de deshidratación e interacción con las cargas del interior del poro.Para que un ion penetre en el poro, debe disociarse de las moléculas de agua que lo recubren en sucesivas capas de solvatación. La tendencia a deshidratarse, o la facilidad para hacerlo, está relacionada con el tamaño del ion: los iones grandes lo hacen con más facilidad que los pequeños, por lo que un poro con centros polares débiles admitirá preferentemente iones grandes, antes que pequeños.
Cuando el interior del canal está tapizado de grupos polares, procedentes de las cadenas laterales de sus aminoácidos componentes, la interacción del ion deshidratado con estos centros puede ser más importante que la facilidad de deshidratación para conferir la especificidad del canal. Por ejemplo, un canal revestido de histidinas y argininas, con grupos cargados positivamente, repelerá de forma selectiva a los iones cargados con el mismo signo, pero facilitará el paso de los cargados negativamente. Además, en este caso, los iones más pequeños pueden interactuar de forma más cercana por cuestiones estéricas, lo cual incrementa en mucho las interacciones carga-carga y, por tanto, exagera el efecto.
Selectividad para no electrolitos
Los no electrolitos, sustancias que generalmente son hidrofóbicas y lipofílicas, suelen atravesar la membrana por disolución en la bicapa lipídica y, por tanto, mediante difusión simple. La facilidad para difundir en este caso es dependiente del coeficiente de partición K, por lo general, si bien existen algunos no electrolitos que atraviesan la membrana por transporte mediado por un transportador.En el caso de que el no electrolito esté parcialmente cargado, es decir, sea más o menos polar, como es el caso del etanol, metanol o urea, se permite el paso a través de la membrana mediante canales acuosos inmersos en la membrana. Es interesante recalcar que no existe un mecanismo de regulación efectivo que establezca barreras a este transporte, lo que implica una vulnerabilidad intrínseca de las células a la penetración de estas moléculas.
Suscribirse a:
Entradas (Atom)